Ingrese su ID de correo electrónico
FISIOLOGIA. / URINARIO / FUNCIÓN TUBULAR
FUNCIÓN TUBULAR
FUNCIÓN TUBULAR
EN LOS TÚBULOS RENALES, MÁS DE 300 MILLONES POR RIÑÓN, SE REALIZA LA DEPURACIÓN DE TODO EL PLASMA QUE PASA POR ELLOS. PARA ESA FUNCIÓN SE UTILIZAN TANTO LOS MECANISMOS DE REABSORCIÓN Y SECRECIÓN NECESARIOS PARA EL EQUILIBRIO DEL MEDIO INTERN0
OBJETIVOS
- Conocer los conceptos de transporte máximo y umbral renal aplicándolos a la reabsorción de glucosa.
- Describir los mecanismos de transporte de aminoácidos y péptidos en los túbulos renales.
- Explicar los mecanismos de reabsorción de cloruro sódico en los distintos segmentos de la nefrona.
- Explicar como se relaciona la reabsorción tubular de agua con la reabsorción de cloruro sódico en los distintos segmentos de la nefrona.
- Conocer como varía la reabsorción en el túbulo proximal cuando se producen variaciones de la fracción de filtración y de las presiones hidrostática y coloidosmótica en el capilar peritubular.
- Describir el balance glomérulotubular y su importancia fisiológica.
- Explicar la importancia de los vasos rectos en la reabsorción de agua y solutos.
- Conocer los mecanismos de reabsorción de bicarbonato y secreción de protones en los túbulos renales, y los mecanismos que amortiguan los cambios del pH en el fluido tubular.
- Conocer la importancia fisiológica del mecanismo de retroalimentación túbuloglomerular. Explicar su funcionamiento ante cambios del volumen extracelular y de la presión arterial
- Explicar como varía la reabsorción y secreción de potasio en los distintos segmentos tubulares cuando se modifica su ingesta.
- Explicar los principales mecanismos que regulan la eliminación renal de potasio.
- Describir como varían la reabsorción de calcio y de fosfato en los distintos segmentos tubulares. Explicar cómo y cuando ejercen su acción los mecanismos que intervienen en la regulación de la reabsorción de calcio y fosfato
- Dadas la concentración plasmática y urinaria de cada compuesto, la tasa de filtración glomerular y la diuresis, calcular la carga filtrada, el transporte tubular, la tasa de excreción y el aclaramiento para: inulina, creatinina, ácido paraamino hipúrico y glucosa. Predecir cómo los cambios en la filtración, la reabsorción y la secreción afectarán la excreción renal de cada compuesto.
- Describir los lugares de la nefrona y los mecanismos moleculares de acción de los diuréticos osmóticos, los inhibidores de la anhidrasa carbónica, los diuréticos de asa, las tiazidas, y los diuréticos ahorradores de potasio.
FUNCIÓN TUBULAR
Como se ha visto en el proceso de filtración glomerular, la fracción de filtración cifrada en un 18% se mantiene constante dentro del margen de autorregulación renal de la presión(entre 80 y 180 mmHg), lo que supone que el ultra filtrado de dicha carga tubular (125 ml/min) es la base con la que los túbulos (1.300.000/riñón aprox.) van a realizar los procesos de reabsorción (resorción = paso de solutos y agua desde el interior tubular al espacio intersticial) y secreción (paso de solutos y agua desde el espacio intersticial al interior tubular), lo que supone que la composición final del líquido tubular, medible en el túbulo colector, sea diferente al ultra filtrado inicial. (Ver tabla 1 de composiciones)
Mediante la actividad reabsortiva tubular, se consigue recuperar todos los solutos de interés fisiológico, aunque este proceso varía según la región tubular, siendo muy activa en la región proximal, donde se produce la reabsorción del 65% del Na+, K+, Cl–, agua y otros solutos así como el 100% de los solutos de interés fisiológico (glucosa, aminoácidos, etc.). El resto de las regiones tubulares se dedican al control de la osmolaridad y pH bajo control hormonal.
La actividad secretora permite regular los excesos de determinadas sustancias de interés fisiológico, además de eliminar sustancias tóxicas. Esta función es compartida por el túbulo proximal y distal.
Consecuentemente la función tubular tiene un significado muy importante dentro del contexto de la homeostasis del medio interno pues:
- elimina los excesos de metabolitos y toxinas,
- regula el volumen líquido corporal mediante el control hormonal de:
- la reabsorción de Na+ y Cl– y secreción de K+ (aldosterona y PNA)
- permeabilidad al agua y urea en túbulo distal y colector (ADH)
- regula el equilibrio ácido – base (pH) del medio interno eliminando el exceso de ácido orgánico mediante la secreción de amonio que favorece el incremento de la capacidad concentradora de H+ de la orina. Así mismo evita que se pierda el bicarbonato filtrado y regenera el consumido por el organismo en la neutralización de los ácidos producidos en el metabolismo.
ECUACIÓN DE LA FUNCIÓN TUBULAR
La ecuación que gobierna la función tubular para cada soluto estudiado se basa en que la cantidad de soluto excretado será igual al filtrado más la transferencia tubular neta (St) del mismo.
Cuando Ts es cero, el soluto tiene una depuración (Ds) igual a la de la inulina, es decir igual a la VFG. Si Ts < 0 es decir, se produce reabsorción, entonces el filtrado será mayor que la depuración del soluto, como le ocurre a la glucosa; mientras que sí Ts > 0, es decir, se produce secreción, el filtrado será menor que la depuración del soluto, como le ocurre al PAH.
Si comparamos la depuración de una sustancia cualquiera con la de la inulina tenemos:

Figura 4

Figura 5: Índice de reabsorción.

Figura 6: Índice de secreción.
Cuando DX es distinto de DIn, la diferencia entre DIn y DX se denomina ÍNDICE DE REABSORCIÓN O ÍNDICE DE SECRECIÓN, y representa el volumen de plasma que en cada minuto es necesario para agregar o reabsorber una cantidad determinada de sustancia.
Para el cálculo de la cantidad de sustancia reabsorbida ver esta figura 5, y para la cantidad de sustancia secretada ver esta figura 6.
MÉTODOS DE ESTUDIO
Estudios de micropunción y microdifusión.
Introducción de micropipetas en distintos segmentos tubulares corticales y medulares para el análisis de la composición tubular.
Mediante técnicas de microperfusión se puede analizar, in vivo, la actividad de resorción. Para ello, se introduce una gota de aceite en la región del túbulo a estudiar. Se introduce en la gota un solución de Ringer, la cual rompe la gota en dos. La velocidad con la cual vuelven a juntarse las dos gotas, mide la velocidad de resorción.
Estudios en vesículas de la membrana:
Se utilizan para el estudio de los mecanismos de transporte. Las vesículas pueden ser del polo luminal o bien del polo basolateral. En ellas podemos controlar la composición del líquido extravesicular e intravesicular.
– Arrastre por solvente
– Difusión simple
Por la vía intercelular suele pasar el agua, dependiendo de la permeabilidad existente en cada región tubular. El movimiento de agua suele arrastrar pequeños solutos de pequeño radio. Por otra parte por difusión simple, es decir en función de los gradientes químicos existentes a ambos lados del túbulo, pequeños solutos no cargados, puede pasar por esta vía, siempre y cuando la permeabilidad para éstos sea apropiada.
Por la vía transcelular se producen las principales transferencias de solutos, los cuales en función de su tamaño y carga, así como la permeabilidad selectiva de cada región tubular, son transferidos mediante mecanismos de transporte activo directo, secundario o por transporte facilitado. Dentro de estos mecanismos de transporte facilitado encontramos diferentes tipos, como cotransportes y antitransportes; pero además algunos de estos transportadores muestran un umbral (U) específico para cada sustancia a partir del cual la excreción se hace proporcional a la filtración. Son los denominados transportadores con Tm, o saturación del mismo, como le ocurre a la glucosa y al PAH. La saturación de dichos transportadores, depende del número de éstos activos, lo que a su vez depende del número de nefronas activas, así como de la concentración plasmática de dicha sustancia.
Características generales del transporte con Tm:
– saturación
– alta especificidad
– inhibición competitiva por moléculas similares
– bloqueo por inhibidores específicos
– depresión por inhibidores metabólicos
Ejemplos de transporte con Tm tenemos uno de reabsorción: titulación de la glucosa y uno de secreción: titulación del PAH.
TITULACIÓN DE LA GLUCOSA (Reabsorción con Tm)
La curva de titulación de la glucosa:
además de ser un ejemplo de transporte con capacidad máxima, sirve para medir la reabsorción renal. Para ello se estudia la excreción de glucosa frente a diferentes concentraciones plasmáticas de la misma.
Animación 1: Titulación de la glucosa.
a) Los cambios plasmáticos de glucosa se consiguen mediante perfusión intravenosa de soluciones de glucosa.
b) La filtración de glucosa se calcula inyectando INULINA para calcular la VFG, la cual se multiplica por la concentración plasmática de glucosa, obteniéndose así la carga tubular de glucosa. La glucosa se filtra a razón de 100 mg/min (80 mg glucosa/dl x 125 ml/min)
c) La diferencia entre la carga tubular de glucosa y la excretada determina la glucosa reabsorbida.
d) A valores normales de glucosa plasmática (80 mg/dl) toda la glucosa filtrada es reabsorbida. La cantidad resorbida es proporcional a la filtrada ([G]p x VFG)
e) Cuando la glucosa plasmática sobrepasa ciertos valores, se produce excreción de la misma. El valor plasmático de glucosa, a partir del cual comienza a producirse su excreción, se denomina UMBRAL RENAL de glucosa. Cifrado en 200 mg/dl de plasma.
f) A medida que aumenta la concentración plasmática de glucosa, a partir de dicho umbral renal, se incrementa la glucosa excretada, ya que las células tubulares no pueden reabsorber toda la glucosa filtrada, alcanzándose así un valor máximo de transporte tubular (Tm). Esto ocurre cuando todos los transportadores de glucosa están saturados. En varones es de 375 mg de glucosa filtrada/min y en mujeres de 300 mg/min.
El cálculo teórico de este Tm sería: TmG = VFG x UG = 1,25 dl/min x 200 mg/dl = 250 mg/dl.
La diferencia entre este valor y el indicado más arriba (375 mg/dl) se debe a que no todas las nefronas se comportan por igual frente a la glucosa, lo que determina el chaflán de la gráfica, alcanzándose el Tm total cuando todas las nefronas se saturan.
El umbral renal para la glucosa (UG) depende de:
– VFG. Si disminuye la VFG se incrementa el umbral, aunque la concentración de glucosa plasmática sea alta.
– Tmg. Si disminuye la Tmg disminuye el umbral.
– Del chaflán o bisel de la curva de reabsorción de la glucosa. El chaflán o bisel que se observa implica que el Tmg es consecuencia del conjunto total de nefronas activas y sus diferentes comportamientos con respecto a la glucosa, así nefronas con alta VFG y baja Tmg determina excreción de glucosa con concentraciones de glucosa plasmática menores que nefronas con baja VFG y alta Tmg. La magnitud de este chaflán es inversamente proporcional a la capacidad de fijación del sistema de transporte. Si aumenta el chaflán se produce una disminución del umbral renal.
La diabetes mellitus no tratada determina un incremento de la excreción de glucosa (glucosuria) que supone una diuresis osmótica (aumento del volumen de orina/min con solutos osmóticos activos).
El mecanismo de transporte tubular luminal para la glucosa es un simporte (cotransporte) con Na+ dependiente del gradiente creado para este último por las bombas de Na+ /K+ de la membrana basolateral, por lo que se denomina transporte activo secundario. Este simportador apical es más afín por el D-isómero.
La glucosa pasa al espacio intersticial mediante un transportador GLUT 2.
El transporte de glucosa se inhibe por la floricina, glucósido vegetal que compite con la d-glucosa.

Tabla
Cuando se alcanza el Tm, éste se hace constante, y en estas condiciones la depuración de la glucosa tiende a igualarse con la de la inulina a medida que aumenta la [G]p según:
DG = DIN - TmG/[G]p (cuando la [G]p aumenta el cociente tiende a cero).
Concepto de reabsorción fraccionada: cantidad de carga tubular que es reabsorbida: STr/[S]p x VFGVpmin
Ver tabla de solutos reabsorbibles con Tm.
TITULACIÓN DEL PAH (Secreción con TM)
Curva de titulación del PAH: Forma de medir la secreción tubular. El estudio del transporte activo que secreta PAH sirve como modelo para el estudio de la secreción tubular con Tm.
La ecuación que gobierna este mecanismo es:
Es = Fs + Ts …………………………………(1)
Animación 2: Titulación del PAH.
La secreción tubular para un soluto depende de la disponibilidad de éste en la circulación peritubular es, de decir, [S]p x FPP (flujo plasmático peritubular), siendo FPP = FPR – VFG, y teniendo en cuenta el 15% de FPR que riega regiones renales no funcionales, el FPP = FPRr – VFG.
De esta forma, la cantidad total de PAH secretado /tiempo = cantidad de PAH entregado por la circulación peritubular/tiempo.
Ts = [S]p x (FPRr – VFG) ……………………. (2)
Volviendo a la ecuación (1) y aplicándola al PAH: T(PAH)S = [PAH]p x (FPRr – VFG)
Prácticamente todo lo que se excreta procede de la secreción (80%), y cuando se alcanza el Tm, la secreción se hace constante y la excreción depende de la filtración.
Si [PAH]p = Umbral renal para el PAH (UPAH) entónces: DPAH = DIN + (TmPAH/[PAH]p), en este caso a medida que aumenta [PAH]p la depuración del PAH se aproxima más a la de la INULINA.
El UPAH está en 0.4 mmol/min = 20 mg/min.
Hay otros compuestos ácidos y básicos que utilizan este sistema de transporte máximo: ver tabla..
Además de los transportes activos indicados, también se producen transferencias tubulares pasivas, dependientes exclusivamente de los gradientes químicos existentes a ambos lados de la pared tubular y de la permeabilidad y por tanto depende del flujo de orina. El aumento de este último supone un incremento de su excreción, por una disminución de su reabsorción. Como ejemplo de este tipo de transporte, tenemos la urea la cual sufre una reabsorción pasiva dependiente de la reabsorción del agua.(Figura 9)
Algo parecido pasa con los ácidos y bases débiles. Cuando éstos son filtrados, a medida que se pierde agua tubular se incrementa la concentración de éstos, creándose así un gradiente químico que favorece la reabsorción de los mismos. La forma que difunde es la no disociada y ésta dependerá del pH y el pK para cada uno de ellos. Como el pH varía a lo largo del túbulo, consecuentemente se producirán flujos de reabsorción y secreción.
Por ejemplo: Ácido débil: AH = A– + H+
pH ácido: Se incrementa la forma difusible y al reabsorberse agua se produce reabsorción.
pH alcalino: Se incrementa la forma no difusible, no hay reabsorción de AH, se retiene agua y disminuye [AH] intratubular por lo que se favorece la secreción de AH.
En consecuencia:
En ambiente tubular ácido se favorece la reabsorción de ácidos débiles.
En ambiente tubular alcalino se favorece la secreción de ácidos débiles y su excreción.
Para las bases débiles:
En ambiente tubular ácido se favorece la secreción y eventual excreción.
En ambiente tubular alcalino se favorece la reabsorción.
Muchos solutos son objeto de reabsorción y secreción a lo largo del túbulo, por lo que el resultado final de la transferencia tubular es consecuencia del movimiento neto. Así por ejemplo, el potasio sufre reabsorción en TP, asa y TD, y secreción en TP y TD. El movimiento neto es de reabsorción, aunque en el caso de que haya alta negatividad tubular, se produce secreción. Otro ejemplo similar es el del ácido úrico.
TOPOGRAFÍA FUNCIONAL TUBULAR
Presenta alta permeabilidad al agua y urea.
Se produce secreción de las mayoría de las sustancias no útiles (PAH, penicilina y otras).
El líquido resultante es isotónico.
Topográficamente se divide en dos regiones:
TÚBULO PROXIMAL CONTORNEADO (TPC) (60% del total tubular)
TÚBULO PROXIMAL RECTO (TPR) (pars recta)
A su vez, también pueden subdividirse en tres subregiones:
Segmento inicial (S1): región inicial y media del TPC
Segmento medio (S2): región final del TPC e inicial del TPR
Segmento final (S3): región cortical profunda y medular del TPR
En esta región tubular, donde se recibe la filtración glomerular (carga tubular), se producen importantes fenómenos de reabsorción y secreción, así como una importante participación en la regulación del equilibrio ácido base del medio interno, mediante la reabsorción del bicarbonato filtrado y en la acidificación de la orina mediante la síntesis de amoniaco.
No se produce glucólisis por carencia de la hexoquinasa, pero si gluconeogénesis, mayor en S1. En S1 también es mayor la actividad de la anhidrasa carbónica y la adenilato ciclasa.
En el borde basolateral destaca la presencia de un gran número de bombas Na+/K+ ATPasa, responsables de crear un importante gradiente electroquímico para el Na+ que favorece su reabsorción, y con él todos los solutos que lo acompañan. También son importantes en la reabsorción del agua. Estas bombas están distribuidas abundantemente a lo largo de la superficie basolateral de casi todos los segmentos tubulares (excepto en el asa descendente y ascendente delgada de Henle). En el TP consumen el 33% del ATP producido.
REABSORCIÓN:
Se produce la reabsorción de todos las sustancias filtradas útiles al organismo (glucosa, aminoácidos, electrólitos, etc.) Recordar que en la circulación peritubular la fuerza neta es de reabsorción.
Como se ha indicado, el motor principal (aunque no el único) de la reabsorción (y secreción) tubular son las bombas basolaterales de Na+ /K+ ATPasa.
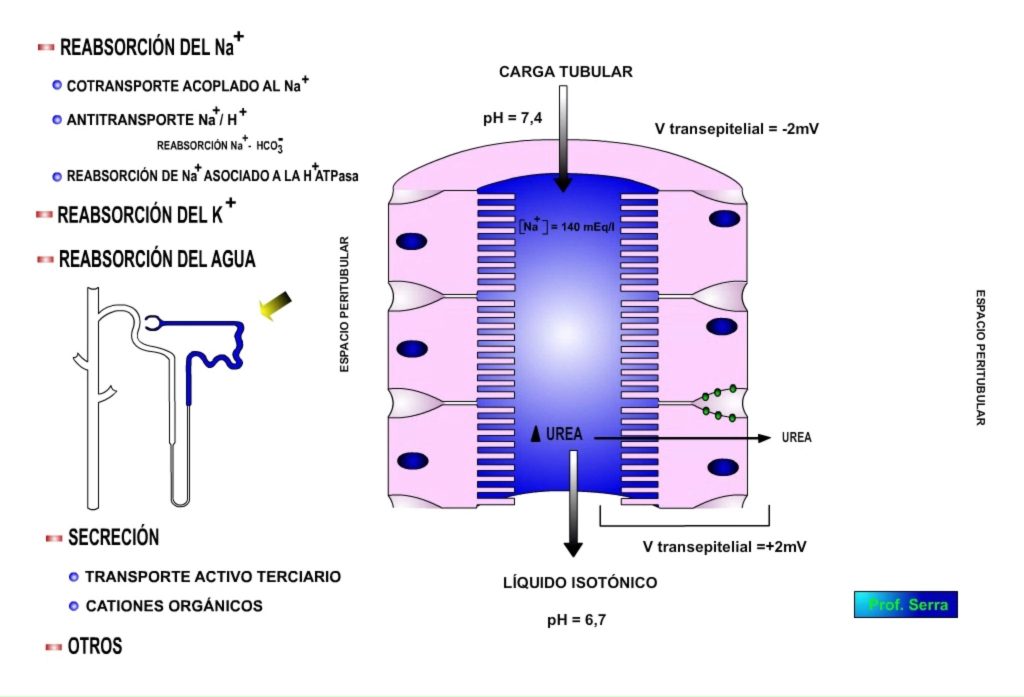
REABSORCIÓN DEL SODIO Y OTROS SOLUTOS ACOPLADOS:
La [Na+ ]T = 140 mEq/l y en el citosol de las células epiteliales tubulares es de 30 a 40 mEq/l y la diferencia de potencial celular es de -70 mV en el interior de la célula, lo que significa un gradiente electro-químico favorable al paso de Na+ tubular hacia la célula. Una vez en la célula se necesita sacarlo hacia el espacio peritubular para que se produzca la reabsorción del Na+. Este último paso viene determinado por la acción de las bombas basolaterales de Na+/K+ ATPasa, las cuales al sacar dos sodio por cada potasio introducido crean un déficit de carga positiva intracelular, que favorece aún más la entrada de sodio desde el espacio luminal.
Hay cuatro mecanismos de reabsorción de Na+ en esta región tubular:
1. PRIMER MECANISMO DE REABSORCIÓN DEL Na+ : COTRANSPORTE Na+ / S
Utilizado por muchos solutos importantes como la glucosa, aa, fosfatos y otros. Se basa en la fuerza electroquímica creada para el Na+ por las bombas basolaterales de Na+/K+ ATPasa.
Para la glucosa se han identificado en este segmento dos cotransportadores apicales Na+/glucosa: el SGLT1 de alta afinidad y baja capacidad localizado en S3, y el SGLT2 de baja afinidad y alta capacidad localizado en S1. El paso basolateral al espacio peritubular se realiza mediante unitransportadores (GLUT1 en S3 y GLUT2 en S1).
No se inhibe por los diuréticos habituales, excepto la floricina. La reabsorción de glucosa es prácticamente del 100% a VFG normal. Pero este tipo de transportador presenta transporte máximo (Tm).
Fosfatos: Se reabsorbe del 80 al 95% acoplado al Na+ (2Na+:Pi). Preferente en S1, ya que la disminución de bicarbonato en S3 hace que el PO4H– pase a PO4H2– menos afín por el transportador apical. Tiene Tm con un umbral cercano a su concentración plasmática.
Depende de su concentración plasmática y la PTH la cual inhibe su reabsorción y estimula su secreción.
Sulfatos: Se reabsorbe acoplado al Na+. Su Tm es muy bajo (0,8 a 1,2 mmol/l). Se produce como sulfúrico en el catabolismo de las proteínas, tamponándose en el lugar de producción. El riñón lo elimina en forma de sal neutra, eliminado simultáneamente el H+ resultante, recuperando así el bicarbonato utilizado en el tamponamiento del sulfúrico.
Los aminoácidos también se transportan ligado al Na+ y con Tm, y se conocen al menos tres tipos de proteínas transportadoras:
a. Para aminoácidos ácidos (glutámico, asparagínico)
b. Básicos: (arginina, lisina y ornitina)
c. Neutros
Ca2+
La carga tubular es de 225 a 270 mmol/ dia
2/3 se reabsorben en TP dependiente de Na+
La PTH controla dicha reabsorción.
2. SEGUNDO MECANISMO DE REABSORCIÓN DEL Na+ : INTERCAMBIADOR Na+ x H+ ligado a la reabsorción de bicarbonato.
Cualquiera de los dos puede actuar como motor de dicho transportador. (Importante en el control de la acidificación de la orina). Supone una caída en la concentración final de bicarbonato en este tramo tubular a 5 mmol/l frente a una carga tubular de 24 mmol/l. Sólo un 8% del bicarbonato filtrado alcanza el AH.
Gradiente túbulo – célula para el Na+
Gradiente célula – túbulo para el H+. Éste desaparece rápidamente del lumen tubular al tamponarse con el bicarbonato luminal, siendo el carbónico producido hidratado por la AC del ribete en cepillo y transformado en CO2 y agua. El CO2 difunde hacia la célula siendo hidratado por la AC intracelular y transformado en H+ y bicarbonato que sale al espacio peritubular con Na+ o intercambiado con Cl– o aniones (A–)(sulfatos, oxalatos, etc.). El cotransporte bicarbonato:sodio basolateral (NBC) es electrogénico, ya que saca 3 bicarbonatos por cada sodio. La acidosis lo activa, así como el NO. Es inactivado por los aumentos de AMPc.
Este anti transporte tiene afinidad por el litio y el amonio y es inhibido por el diurético AMILORIDE.
La caída de H+ supone caída de carga positiva luminal y por tanto mayor negatividad que empuja a los aniones hacia el espacio peritubular.
Como hemos visto, el bicarbonato se reabsorbe acoplado al intercambiador Na+ x H+ . La regulación de este intercambiador es esencial en el control del pH del organismo.
Se han reconocido tres tipos de intercambiadores apicales Na+ x H+. El NHE1, común en todas las células del organismo e implicado en la regulación del pH intracelular. Normalmente inactivo en la nefrona.
El NHE2 localizado en membrana apical de TP y AH, también es poco activo en condiciones normales.
El NHE3 apical y específico del riñón, localizado en TP y AH. Este intercambiador está regulado por hormonas, como la PTH y el glucagón, que aumentan la producción de AMPc, lo cual inhibe su actividad. Mientras que las que disminuyen la concentración de AMPc (AII, agonistas a-adrenérgicos, endotelina 1) aumentan su actividad.
3. REABSORCIÓN DE Na+ DEPENDIENTE DE LA H+ ATPasa apical :
Esta bomba ubicada en el fondo de las vellosidades saca hidrogeniones a la luz tubular (1/3 de los H+ secretados). Y es responsable del 20 al 35% de la reabsorción de Na+ y bicarbonato. Realmente actúa como regulador del pH intracelular.
4. REABSORCIÓN PASIVA DE Na+ Y Cl–
En las regiones S2 y S3 la permeabilidad al Cl– está muy aumentada, igual que su concentración tubular por lo que pasa Cl– y Na+ por el espacio intercelular.
POTASIO:
El K+ se reabsorbe en S1 y S2 de forma independiente de los ingresos y egresos de K+, y sale basolateralmente tanto por conductancias específicas como acoplado al Cl– mediante un transportador electroneutro.
REABSORCIÓN ISOTÓNICA DE AGUA, debida a la gran permeabilidad hidráulica de esta región.
Una gran proporción del agua filtrada es reabsorbida en este segmento. La permeabilidad es muy alta, y aunque no hay gradiente osmótico entre la luz tubular y el capilar, el agua pasa gracias al gradiente osmótico local basolateral creado por la actividad de las bombas Na+/K+ ATPasa, que permite el paso de agua tubular a dicho espacio, aumentando la presión hidrostática que empuja el agua hacia el capilar.
En esta región se localizan permeasas o acuaporinas, tipo AQP1 no regulada hormonalmente y localizada en ambos lados de la célula.
SECRECIÓN EN TP:
Se produce secreción de todos los ácidos y bases orgánicas, toxinas, antibióticos, drogas y excesos metabólicos de sustancias útiles. La mayoría con Tm.
Dos ejemplos típicos de mecanismos de secreción en TP:
Secreción por transporte activo terciario:
Como ejemplo tenemos el utilizado por el PAH. Para ello el alfa-cetoglutarato se acumula en la célula por cotransporte con el Na+. El alfa-cetoglutarato se intercambia en la membrana basolateral por el PAH, el cual sale al espacio luminal intercambiándose por Cl– o similar.
Este sistema requiere dos transportadores en serie, uno en la membrana basolateral y otro en la apical, compartidos con otros aniones orgánicos competidores. Ambos dependen de la bomba de Na+/K+ ATPasa basolateral, de ahí su nombre de transporte terciario. Y son transportadores con transporte máximo (Tm).
Existe competitividad por el transportador entre los diferentes aniones, lo que supone que el aumento en el transporte de un anión se hace en detrimento de otro anión que quedará en plasma (importante en Farmacología).
Cationes orgánicos:
Aminas y compuestos de amonio entran por la superficie basolateral por difusión mediada o no. Su secreción luminal es activa, mediante un intercambiador catión x H+.
Algunos pasan por difusión pasiva y depende del pH, de manera que su forma no ionizada puede ser liposoluble y pasar fácilmente las membranas, de acuerdo a su gradiente electroquímico.
También presentan los diferentes cationes orgánicos competitividad por el transportador.
Se sintetiza y secreta NH3 para el control del pH tubular, (amoniogénesis).
OTROS SOLUTOS:
Proteínas. Aquellas menores que la albúmina se reabsorben normalmente en esta región, siendo degradadas totalmente en el interior celular. No obstante, en las medidas urinarias puede aparecer como normal unos valores de 3 mg de proteínas/día. El límite máximo se estima en 150 mg/día.
Ácido úrico:
Es producto metabólico del metabolismo de las purinas.
La carga tubular de úrico en humanos es del 10% mientras que en el resto de los animales es del 100% (por acción de la uricaza que la degrada a alantoína que es excretada).
Se excreta el 10% del filtrado, por lo que predomina su reabsorción. Se reabsorbe en TP (inhibido por la PROBENECID).
Si disminuye su FF incrementa su concentración plasmática produciéndose artritis gotosa.
Al pH tubular tiende a cristalizar originando cálculos renales.

Figura 15: Excreción de urea.

Figura 16: Contenido luminal de diferentes solutos, a lo largo del túbulo proximal.
Urea (Figura 15):
Producto final del catabolismo proteínico.
Por ser liposoluble pasa por difusión simple, por lo que sigue su gradiente de concentración y también es arrastrado por el solvente.
La concentración plasmática de urea es aproximadamente de 8 a 20 mg/dl (depende del contenido proteínico de la dieta).La filtración es libre en esta región tubular, luego la carga tubular será VFG x [urea]p.
En este segmento se produce reabsorción del 50% de la filtrada.
En esta figura 16 se puede ver el contenido luminal de diferentes solutos, a lo largo del túbulo proximal.
ASA de HENLE (AH)
Existen dos tipos de asas. Las que acaban en la unión cortico medular y las que penetran en la médula profunda (menos numerosas) correspondientes a las nefronas yuxtamedulares. Estas últimas están implicadas en la creación del gradiente osmótico cortico medular necesario para el control de la osmolaridad final de la orina y por tanto, en la conservación del agua corporal.
La reabsorción de Na+ es fija (un 85% de la carga procedente del TP) con lo cual se asegura que la carga de Na+ que llega a los TD y CC sea pequeña y adecuada para los ajustes finos finales de la osmolalidad del líquido extracelular. (25% del Na filtrado y el 15% del agua filtrada). Se realiza en el AHAD y AHAG.
Las asas largas reabsorben más ClNa que las cortas.
Anatómica y funcionalmente se divide en tres segmentos:
El asa descendente delgada AHDD
El asa ascendente delgada AHAD
El asa ascendente gruesa AHAG
El líquido que llega es de tipo isotónico y el que sale es bastante HIPOTÓNICO (100 mOsm/Kg de agua). El pH es de 6,7 y el potencial transepitelial inicial de 2 mV.
Causas de la hipotonicidad:
Diferentes permeabilidades regionales al agua e iones osmóticos y urea.
SEGMENTO DESCENDENTE DELGADO (AHDD): (Figura 17)
MUY PERMEABLE AL AGUA
Reabsorción de agua por ser más hiperosmótico el espacio peritubular.
IMPERMEABLE AL ClNa Y UREA
Incremento [ClNa]T
Incremento [UREA]tubular
LÍQUIDO INTRATUBULAR HIPEROSMÓTICO. El líquido que llega a la curvatura del asa es hipertónico, por aumento en la concentración intratubular de ClNa y urea.
Cotransportador apical (NKCC2): 1Na+ / 1 K+/2Cl– , supone la REABSORCIÓN ACTIVA de Na+ y Cl–. Este cotransportador se reactiva en condiciones de hidropenia (incluso en el TP y TD). Cuando hay depleción de volumen, la ADH incrementa (vía AMPc) su actividad, mientras que en estados de sobrecarga salina, se inhibe, inhibición mediada por el NO.
La FUROSEMIDA inhibe este cotransportador.
También nos encontramos con el intercambiador apical H+x Na+ (NHE3) con el cual se sigue reabsorbiendo el poco bicarbonato que llega, así como Na+.
El intercambio K+ x NH4+ muy importante en la amoniogénesis tubular, donde el amonio pasará al intersticio para ser extraído por el CC. Es inhibido por la ADH.
IMPERMEABILIDAD AL AGUA Y UREA
LÍQUIDO TUBULAR FINAL MÁS HIPOOSMOLAR Y ESPACIO PERITUBULAR MÁS OSMOLAL.
El K+ sale de la célula en función de su gradiente electroquímico y el Cl– pasa al espacio peritubular gracias a un cotransportador basolateral Cl– : K+.
Este movimiento iónico supone un V transepitelial de + 6mV, lo que favorece la salida de pequeños cationes luminales por los espacios intercelulares.
TÚBULO CONTORNEADO DISTAL (TCD)
REABSORCIÓN ACTIVA de Na+
IMPERMEABLE AL AGUA Y UREA
Secreción de H+ , K+ y NH3.
LÍQUIDO MÁS HIPOOSMOLAR
Esta región tubular se caracteriza por una baja capacidad de transporte, por lo que comparativamente con el TP reabsorbe menos. La reabsorción depende de la carga tubular, aumentando si aumenta ésta y viceversa.
Este túbulo más el colector reabsorben el 8% del sodio filtrado.
Superficie luminal:
En túbulo contorneado distal, el movimiento de ClNa se realiza mediante cotransporte Na+/Cl- (inhibido por las tiazidas). Por lo que el líquido tubular se hace aún más hipotónico.
En el lado basolateral encontramos un intercambiador 2Na+ x Ca2+ que saca el Na+ introducido en la célula por el cotransportador Na+/Cl– apical. Si aumenta la entrada de sodio se incrementa la excreción de calcio. Por este motivo la aldosterona aumenta la excreción de calcio. Se localiza en todo el TD. Además tenemos la bomba Na+/K+ATPasa, canal basolateral de potasio. Y en las células intercalares también intercambiadores cloruro/bicarbonato y bomba de hidrogeniones.
EL LÍQUIDO QUE SALE ES MUY HIPOTÓNICO Y EL POTENCIAL TRANSEPITELIAL NEGATIVO.
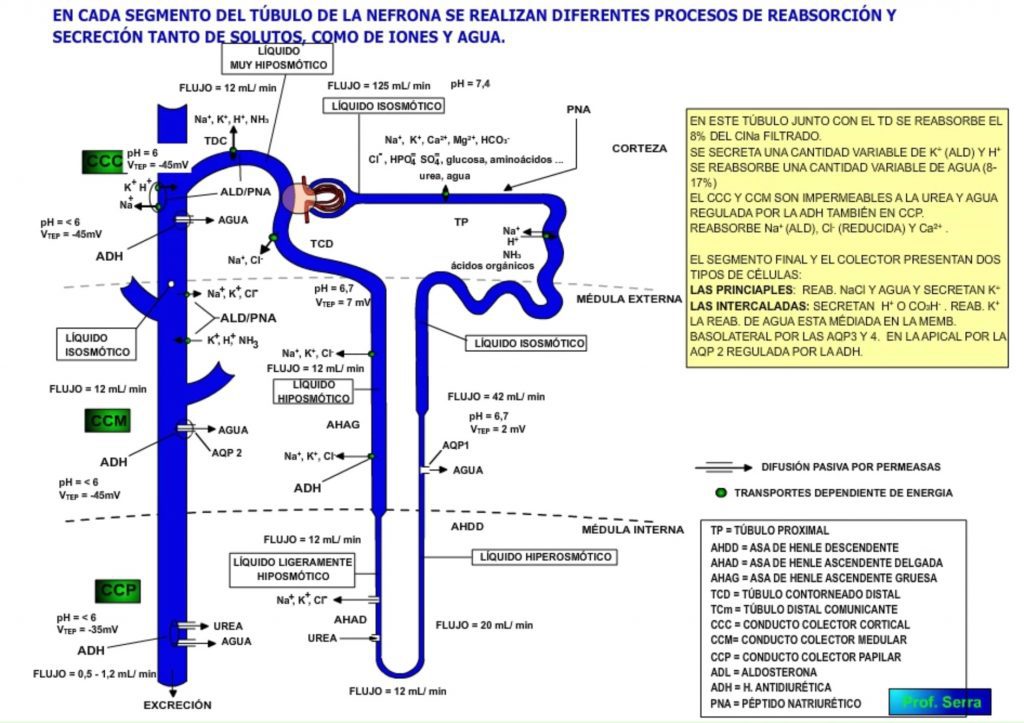
CONDUCTO COLECTOR CORTICAL Y MEDULAR
– REABSORCIÓN ACTIVA de Na+ dep de ALD y PNA.
– PERMEABILIDAD REDUCIDAD AL Cl–
– SECRECIÓN DE K+ e H+ dependiente de ALD.
– IMPERMEABILIDAD A LA UREA Y AL AGUA, ESTA ÚLTIMA DEPENDE DE LA PRESENCIA DE ADH.
CONDUCTO COLECTOR PAPILAR:
– REABSORCIÓN activa de Na+ dep de ALD
- PERMEABILIDAD AL AGUA Y UREA (dependiente de la ADH)
Ambas aumentan con la carga tubular y viceversa hasta ciertos límites ya que al disminuir el flujo aumenta el tiempo de permanencia y se reabsorbe más agua y urea.
Primera característica de esta región es que las uniones intercelulares son muy estrechas, por lo que hay muy poco desplazamiento de Na+ y Cl-.
Las células principales de estos segmentos, reabsorben el sodio mediante canales específicos dependientes de la aldosterona, denominados canales epiteliales de sodio (ENaC) por encontrarse en diferentes epitelios. Estos canales se inactivan por la amilorida, el PNA y prostaglandinas. Esta reabsorción de sodio no va acompañada de forma equimolar por el cloruro por lo que se establece un potencial transepitelial con el interior tubular negativo que favorece la reabsorción del cloruro. La ALDOSTERONA también regula la actividad de las bombas Na+/K+ ATPasa basolaterales, fundamentales para el transporte luminal.
Todos los segmentos del CC y la parte final del TD, presentan un tipo de célula epitelial denominado intercalar que se sitúan entre las células tubulares normales (principales) y participan de forma importante en la regulación ácido base. Las células I tipo A secretan H+ hacia el túbulo mientras que las tipo B lo transportan hacia el intersticio. La actividad de estas células depende del pH tubular.
En estas células se produce un intercambio luminal Na+/H+. También se puede producir una activación de la reabsorción activa del potasio en caso de depleción del mismo, mediante tres posibles mecanismos: a) una bomba electrogénica de potasio; b) un transportador electroneutro K+/Cl–; c) la bomba K+/H+ATPasa, regulada por factores como la ingestión de potasio y el estado ácido-base del MI.
El K+ es secretado por las células principales, gracias a la presencia de un canal apical de K+ (ROM K) regulado también por la aldosterona y por el calcio intracelular vía calmodulina. El H+ tubular inhibe la secreción de K+, activándolo la presencia de bicarbonato tubular. También se estimula con el incremento de K+ en la dieta o en el medio extracelular.
El K+ que aparece en la orina procede fundamentalmente de la secreción realizada en esta región tubular. Sólo un 10% de la carga de K+ filtrada llega al TDC. En este último y en el Colector es donde se realiza el ajuste fino de dicho ion.
Cuando la [K+ ]p > 4,2 mEq/l (normal) su excreción crece rápidamente, en ausencia de ADH. Puede ser que el incremento plasmático de este ión afecte directamente a la actividad de las bombas Na+ /K+ basolaterales de las células tubulares colectoras. Cuando se produce su depleción, hay evidencias de que en las células intercalares de la región medular se produce una reabsorción activa del mismo, fundamentalmente a través de una bomba bomba de K+/H+ ATPasa, que depende del estado nutricional del sujeto y el pH del MI, afectándose así los movimientos de los hidrogeniones.
Factores que afectan a la secreción de K+:
– Actividad de las bombas Na+/K+ basolaterales
– Diferencia de potencial transepitelial. (Si aumenta la negatividad luminal, aumenta su secreción)
– Permeabilidad apical al K+ (regulada por la ALD)
– Flujo luminal (si aumenta, aumenta su secreción).
– La aldosterona (ALD).
En lo que se refiere a las células intercaladas y su manejo del H+, encontramos en las tipo A la bomba de H+ similar a la del TP, implicada en la regulación del pH intracelular. Y una bomba de K+/H+ ATPasa implicada en la acidificación de la orina, en la captura de NH3 en forma de NH4+ y en la titulación de los ácidos titulables. Y un intercambiado basolateral Cl– / CO3H–.
En las células tipo B se encuentran dos: Cl– / CO3H– (apical) y bomba de H+(basolateral).
Respecto a la urea, ésta entra en el CCC en alta concentración y aumenta aún más a medida que avanza ya que el CCC y el CCME son impermeables a la urea, no así el CCMI que si es permeable pero dependiente de la ADH.
Se conocen tres transportadores renales en conducto colector y vasa recta:
El UT1: transportador con cinética saturable se localiza en la región medular interna en su membrana apical, siendo responsable de la reabsorción de urea. Está regulada por la ADH.
El UT2: canal con alta capacidad de transporte. Se encuentra en la porción inicial del asa ascendente delgada de Henle por donde entra la urea desde la médula renal.
El UT3: se encuentra en la región medular de los vasa recta descendente y está involucrada en el proceso de intercambio de urea entre las dos ramas de éstos vasos.
El agua que llega al conducto colector es mantenida en su interior ya que tanto el CCC como el CCME son impermeables salvo en presencia de ADH. Sin embargo, el CCMI es permeable al agua, permeabilidad que aumenta en presencia de la ADH. Las permeasas o acuaporinas de esta región son diferentes según la polaridad de la membrana de la célula. Así en la membrana apical se expresa la ACUAPORINA 2 (AQP2) dependiente de ADH, mientras que en la membrana basolateral se expresan constitutivamente las AQUOPORINAS 3 Y 4 (AQP3 y AQP4).
En cada túbulo colector drenan un conjunto de diferentes nefronas tanto corticales como yuxtamedulares, por lo que la composición de su liquido intratubular es variable. No obstante, normalmente el líquido que le llega es bastante hipotónico, (150 mOsm/Kg. H2O) (Unos 100 mmol de electrólitos y 50 mmol de urea.)
REGULACIÓN DE LA FUNCIÓN TUBULAR
Tanto la filtración como la reabsorción están finamente reguladas por diferentes mecanismos de tipo nervioso, hormonal y local. Y como una característica importante tenemos que mencionar que tanto la excreción de agua como la de los solutos se hace de forma independiente y bajo control hormonal.
Es conocido que la cantidad de agua y solutos que llegan a los túbulos contorneados distales y los conductos colectores (el así llamado “nefrón distal”) está determinada por dos mecanismos interrelacionados que estabilizan el balance entre la TFG y la tasa de reabsorción de filtrado en el túbulo proximal y en el asa de Henle (el así llamado “nefrón proximal”) (Animación 3). El primero es el mecanismo de retroalimentación túbulo-glomerular (RTG), que disminuye la TFG en respuesta a un aumento en la concentración de NaCl a nivel de la macula densa (MD) por encima de su valor normal, causado por una disminución en la reabsorción de agua y NaCl en el nefrón proximal, o causado por un aumento primario en la TFG.
Animación 3: Nefrón proximal.
El segundo es un aumento adaptativo en la reabsorción proximal de agua y NaCl en respuesta a un aumento espontáneo en la carga filtrada, un fenómeno conocido como balance glomérulo-túbular (BGT). Éste actúa mediante dos mecanismos. Uno por las fuerzas de Starling, por cuanto un aumento de la TFG supone un aumento de la presión oncótica peritubular que supone una fuerza neta de reabsorción. El otro es por un aumento de la carga filtrada de glucosa y aminoácidos que favorece la reabsorción del sodio y agua en TP.
En términos de regulación, el RTG actúa como un mecanismo de retroalimentación negativa, que ajusta la TFG para compensar una inadecuada reabsorción de filtrado en el nefrón distal, mientras que el BGT actúa como un mecanismo de pre alimentación positiva para aumentar la reabsorción en el nefrón proximal en respuesta a un incremento en la TFG. Ambos mecanismos son reajustados con maniobras que reducen el volumen extracelular. Así, en una hemorragia aguda se espera que aumente la eficiencia de la respuesta del RTG.
Este aparato parece funcionar como una unidad reguladora que, a través de las células de la mácula densa (MD), es capaz de detectar la concentración de NaCl en el líquido tubular distal. El sistema es activado cuando la concentración de electrolitos aumenta, llevando a reducción en la presión capilar glomerular y en la TFG a través de la activación del mecanismo de RTG. La manera cómo las células de la MD pueden participar detectando y transmitiendo información a las estructuras vasculares y glomerulares, es aún una incógnita, aunque está claro que se realiza a través de moléculas activas.
EL EFECTO HORMONAL SOBRE LA FUNCIÓN TUBULAR.(Figura 23)
Cuando hay una disminución de la TFG o una disminución del volumen plasmático se activa el sistema renina-angiotensina. la ANGII actúa sobre la presión arterial aumentándola, pero también ejerce un efecto importante en la reabsorción del sodio tanto en TP (con agua), como en AHAG y TD y CC. Además de activar la secreción de aldosterona.
La aldosterona incrementa su secreción por disminución del sodio o incremento del potasio plasmático (también por acción de la ANGII) (el péptido natriurético la disminuye). Actúa en el AHAG, y más en TD y CC, incrementando la reabsorción del sodio por varios mecanismos: 1) incremento de bombas Na/K basolaterales; 2) activando la expresión del canal ENaC apical; 3) elevando los valores de Sgk1 (cinasa sérica estimulada por glucocorticoides) que aumenta la expresión de los ENaC; 4) estimulando el CAP1 (proteasa activadora del canal ENaC).
También activa la secreción de potasio en TD y CC.
Consecuencia de su acción sobre la reabsorción del sodio es el incremento de la negatividad del túbulo que favorece la reabsorción del cloruro por vía paracelular.
Los péptidos natriuréticos (PNA y PNB) aumentan por un incremento del volumen plasmático y aumento de la presión sanguínea. Consecuencia: la disminución de la presión sanguínea por disminución de la resistencia periférica total y aumento de la excreción renal de ClNa y agua. Inhiben la reabsorción de ClNa en CC y la mediada por la ADH. Reducen la secreción de la ADH. La natriuresis del PNA es mayor que la del PNB.
La urodilatina es un péptido muy parecido al PNA (cuatro aa más) secretado por el TD y CC. es de acción local. aumenta por un aumento del volumen plasmático y la presión. Inhibe la reabsorción del ClNa y agua en la región medular del CC. Es más potente que el PNA.
La uroguanilina y la guanilina, se producen en el intestino delgado en respuesta a la ingestión de ClNa. Pasan a sangre e inhiben la reabsorción de ClNa y agua en los riñones.
Las catecolaminas procedentes de la inervación simpática y de la médula adrenal tienen un efecto estimulador tanto en TP, como en AHAG, TD y CC, de la reabsorción de ClNa y agua.
La dopamina, procede de las terminaciones nerviosa dopaminérgicas renales y del TP. Aumenta por aumento del volumen del LEC e inhibe la reabsorción del ClNa y agua en TP.
La adrenomedulina, hormona peptídica que se produce en muchos tejidos incluidos los riñones. Se estimula por fallo cardíaco congestivo e hipertensión. Tiene efectos natriuréticos y diuréticos a través de un aumento de la TFG y el flujo sanguíneo renal.
ENLACES DEL TEMA EN LA WEB
VIDEOS EN YOUTUBE
PATOLOGÍA
FISIOLOGIA. / URINARIO / FUNCIÓN TUBULAR
![]()


















 Views Today : 29
Views Today : 29 Views This Month : 1894
Views This Month : 1894 Views This Year : 27517
Views This Year : 27517 Total views : 313580
Total views : 313580
2 comentario en “Función tubular”