Regulación del sistema respiratorio
Ingrese su ID de correo electrónico
FISIOLOGIA. / RESPIRATORIO / REGULACIÓN DEL SISTEMA RESPIRATORIO
REGULACIÓN DEL SISTEMA RESPIRATORIO
REGULACIÓN DEL SISTEMA RESPIRATORIO
LA REGULACIÓN DEL SISTEMA RESPIRATORIO TIENE COMO OBJETO, MANTENER LAS PRESIONES NORMALES DE OXÍGENO, ANHÍDRIDO CARBÓNICO Y LA CONCENTRACIÓN DE IONES H+, ADECUANDO LA VENTILACIÓN PULMONAR A LAS NECESIDADES METABÓLICAS DE CONSUMO Y PRODUCCIÓN DE AMBOS GASES.
OBJETIVOS
- Describir la organización central y generación del ritmo respiratorio.
- Analizar los efectos de la PaCO2, pH y PaO2 sobre la ventilación.
- Explicar los reflejos respiratorios de origen químico.
- Explicar los reflejos respiratorios de origen pulmonar.
- Explicar los reflejos respiratorios de origen extrapulmonar.
- Explicar algunas de las alteraciones respiratorias
REGULACIÓN NERVIOSA DEL SISTEMA RESPIRATORIO
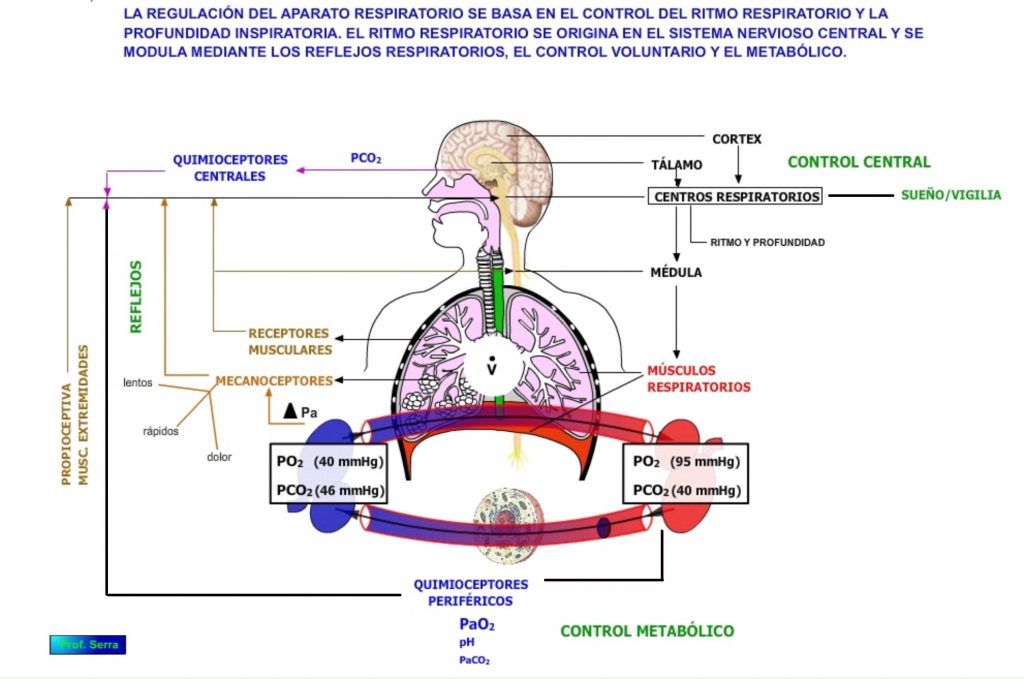
La actividad del aparato respiratorio se encuentra regulada por los centros respiratorios ubicados en el sistema nervioso central. Centros donde además se origina el ritmo respiratorio. (Figura 1)
De estos centros, no bien delimitados en la actualidad, parten axones que contralateralmente e ipsilateralmente van hacia las motoneuronas (Mns) inspiratorias y espiratorias espinales, las cuales inervan a los músculos respiratorios, así como a los músculos accesorios respiratorios.
Estos centros reciben información sensorial de los quimiorreceptores (periféricos y centrales) que testan las PaCO2 y PaO2, aunque la primera es la que normalmente tiene mayor preponderancia en el control respiratorio. También reciben información sensorial de los mecanoceptores de distensión pulmonar, así como de otros sensores torácicos, bronquiales, etc. Toda esta información se integra en forma de reflejos respiratorios, que junto con los datos procedentes del aparato circulatorio y otros centros nerviosos, definen un patrón respiratorio encargado de modular la frecuencia y la profundidad del ritmo respiratorio.
Tres son los patrones de control que podemos definir:
El metabólico, determinado por los niveles de la PaCO2, reflejo del metabolismo celular y de la propia ventilación alveolar. Su resultado es un cambio en la frecuencia respiratoria y la profundidad de la inspiración. Cuando el organismo se encuentra en estado de hipoxemia, el estímulo de la PaO2 supera el efecto regulador de la PaCO2.
El otro patrón, es el voluntario, organizado por el córtex y el tálamo, mediante los cuales se pueden organizar respuestas respiratorias frente a diferentes situaciones como el parto, el habla, el canto, el silbar, tragar, toser, defecar, estados de ansiedad, de miedo, etc. Estas áreas cerebrales envían sus axones a los centros respiratorios para modular en ellos, tanto la frecuencia como la profundidad respiratoria.
Por último tenemos el patrón respiratorio determinado por el estado de sueño/vigilia del sujeto. Este estado viene definido por la actividad de la formación reticular, que invade todo el tronco del encéfalo con su consiguiente influencia en los centros nerviosos ubicados en el mismo; determinando dos patrones respiratorios diferenciados, uno es el correspondiente al estado de vigilia y el otro es característico del estado del sueño.
CENTROS RESPIRATORIOS
Localización de los centro nerviosos implicados en la generación del ritmo respiratorio (Figura 2):
Mediante estudios de ablación y registros electrofisiológicos relacionados con la actividad respiratoria, se ha podido localizar la ubicación de los centros nerviosos implicados en la generación y regulación del ritmo respiratorio.

Figura-2: Centros reguladores de la respiración.
En el bulbo, en su formación reticular y por debajo del piso del cuarto ventrículo, se encuentran centros implicados directamente en la autogeneración del ritmo respiratorio básico y son:
1. El grupo respiratorio dorsal (GRD), implicado principalmente en la inspiración y que algunos consideran es responsable del ritmo respiratorio.
2. El grupo respiratorio ventral (GRV), relacionado principalmente en la espiración.
El primero (GRD) está localizado en los confines del núcleo del tracto solitario (NTS), con neuronas activas durante la inspiración. Con axones contralaterales que inervan a través del frénico el diafragma y axones contralaterales que van al GRV, inhibiendo a sus neuronas espiratorias. Éste recibe gran parte de la información sensorial respiratoria. Tiene actividad rítmica y es responsable del ritmo básico ventilatorio.
El segundo grupo (GRV) contiene dos poblaciones de neuronas unas en el núcleo ambiguo, con neuronas premotoras inspiratorias además de neuronas motoras de los músculos laríngeos y parasimpáticas a los bronquiolos y corazón. Otras en el retroambiguo, donde en su región rostral encontramos neuronas premotoras inspiratorias (I) con axones contralaterales hacia las Mns espinales que inervan a los músculos intercostales externos (inspiratorios) y músculos accesorios. En su región caudal, se encuentran neuronas premotoras espiratorias (E) que inervan de forma ipsilateral a las Mns espinales que inervan a los intercostales internos (espiratorios) y músculos abdominales. Las neuronas E parecen tener efectos inhibitorios durante la fase inspiratoria sobre las neuronas I, siendo así responsables de la finalización de dicha fase.
El complejo de Bötzinger (centro apnéusico) está compuesto exclusivamente por neuronas espiratorias que reciben entrada sensorial desde el NTS y tienen un efecto inhibitorio sobre las neuronas inspiratorias del GRD y GRV y un efecto excitatorio sobre las neuronas espiratorias del GRV.
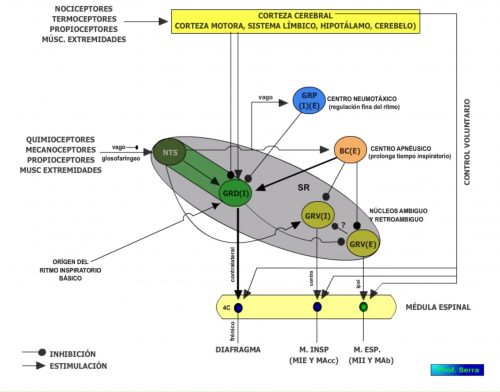
Figura-3: Organización neuronal de los centros reguladores respiratorios.
La información sensorial del vago es de tipo inhibidor sobre las neuronas inspiratorias.
En el puente tenemos:
Neuronas del grupo respiratorio del puente (GRP) (antiguamente conocidas como centro neumotáxico) son de tipo inspiratorio localizadas en el núcleo parabraquial lateral (NPL) y núcleo de Kölikker-Fuse (NKF) y espiratorio en el núcleo parabraquial media (NPM). Parece implicado en la regulación de la profundidad inspiratoria y recibe información sensorial vagal. Los dos primeros regulan el ritmo inspiratorio actuando sobre el GRD.
ESTOS GRUPOS ORGANIZAN LA INFORMACIÓN NECESARIA PARA GENERAR EL RITMO RESPIRATORIO Y LA PROFUNDIDAD DE LA INSPIRACIÓN (Figura 3), SIENDO EL GRUPO RESPIRATORIO VENTRAL DONDE SE ORIGINA EL RITMO Y EL RESTO SE ENCARGAN DE MODULARLO.
ORIGEN DEL RITMO RESPIRATORIO
Hay varias hipótesis que intentan explicar la generación del ritmo respiratorio básico, basándose en los diferentes tipos de neuronas inspiratorias y espiratorias que se han podido diferenciar en las diferentes regiones involucradas del SNC. Entre éstas mencionamos la siguiente que se basa en la existencia de grupos neuronales de la formación reticular (CENTRO INTEGRADOR DE LA ACTIVIDAD INSPIRATORIA)(posiblemente interneuronas del GRD) responsables del inicio inspiratorio, las cuales están disparando de forma tónica, excitando a las neuronas inspiratorias premotoras de los GRD y GRV. Esta excitación se mantiene hasta que se ve interrumpida por la acción de otro grupo de neuronas, posiblemente ubicadas en el GRV, que actúan como neuronas INTERRUPTORAS de la inspiración, las cuales reciben información activadora tanto del CENTRO INTEGRADOR, como de los receptores de estiramiento pulmonar, y cuando la excitación llega a un umbral preestablecido, generan una fuerte inhibición en el CENTRO INTEGRADOR, por lo que cesa la inspiración hasta que dicho centro deja de recibir la inhibición del centro interruptor, liberando nuevamente a sus neuronas tónicas inspiratorias. La ventaja de este modelo es que explica cómo se regula el tiempo de inspiración y su profundidad, ya que el umbral de referencia indicado puede modularse mediante la información procedente de los centros superiores, a través del GRP, así como de los mismos sensores periféricos (quimiosensores, mecanosensores, etc.)
La espiración aún siendo pasiva en la respiración eupnéica, tiene actividad neuronal. La primera fase espiratoria se acompaña de actividad muscular inspiratoria -a través del frénico- que determina un freno a la posible rapidez de la expulsión del aire provocada por el rebote elástico. En la segunda fase espiratoria cesa la actividad de los músculos inspiratorios y se mantiene la retracción elástica continua, o la activación de los músculos espiratorios si la espiración no es eupnéica. La duración de la espiración viene determinada por el tiempo de inhibición del "centro integrador inspiratorio".
Animación 1. Explicación del ritmo respiratorio.
Independientemente de cómo se genera el ritmo, éste puede ser modulado por las entradas sensoriales del aparato respiratorio, así como por las del aparato cardiovascular además de la información procedente de los centros nerviosos superiores, donde se integra la respuesta respiratoria con otras funciones orgánicas, conductas e incluso el control voluntario de la misma.
En el hipotálamo hay neuronas que generan una excitación basal continua dirigida al GRD. Además los centros reguladores de la temperatura y los encargados de la respuesta defensiva, también controlan los centros respiratorios bulbares.
Neuronas del córtex cerebral ejercen un efecto inhibidor continuo tanto en el hipotálamo como en el GRD. Y junto con el sistema límbico determinan las respuestas respiratorias asociadas con las emociones y el dolor.
Durante el ejercicio el córtex cerebral motor activa a las neuronas del GRD incrementando la respuesta respiratoria.
El control voluntario de la respiración nace en el córtex cerebral, cuyas neuronas ejercen un efecto directo sobre las motoneuronas medulares mediante la vía piramidal.
2. El hecho de que entre los valores de 60 a 100 mm Hg en la PA O2 no se produzca un cambio importante en la ventilación se puede explicar por la acción cooperativa de dos efectos: la disminución de la P CO2 como consecuencia del ligero aumento de la ventilación, lo que supone inhibición de la misma; y el aumento de la desoxiHb que por ser un ácido débil hace subir el pH sanguíneo y consiguiente depresión de la ventilación.
El hecho de que esta falta de respuesta a la bajada de P O2 no afecte a la normal oxigenación, dentro de los límites 60-100, de los tejidos se debe a la alta saturación de la Hb para estos valores de presión.
REFLEJOS RESPIRATORIOS
EL CONTROL del ritmo y profundidad respiratoria es la consecuencia de la integración de todas las aferencias que llegan a los centros respiratorios bulbares, donde se origina el ritmo básico respiratorio.

Figura-4: Organización de los reflejos pulmonares.
El objetivo de este control radica en encontrar la combinación óptima de frecuencia y volumen ventilatorio para lograr la ventilación con esfuerzo mínimo. Y es muy importante el estado de vigilia del sujeto.
AFERENCIAS SENSORIALES EN EL CONTROL DEL APARATO RESPIRATORIO:
La información sensorial que llega a los centros respiratorios para modular la frecuencia y profundidad respiratoria se pueden clasificar en tres, de acuerdo con el tipo de información que llevan:
1. Información química: procedente de los quimioceptores periféricos ubicados en la circulación arterial, donde se miden los niveles plasmáticos de O2, CO2 y el pH; y los centrales, ubicados en el suelo del cuarto ventrículo y miden el CO2 del líquido cefalorraquídeo.
2. Información propioceptora: que traen información de la actividad muscular tanto de los músculos respiratorios, como de los músculos de las extremidades.
3. Información mecanoceptora: procedente de los barorreceptores ubicados en la región pulmonar y también en el sistema cardiovascular.
Otras informaciones sensoriales también ejercen su efecto respiratorio pero no de forma directa, sino a través de centros superiores ubicados en el hipotálamo, sistema límbico y córtex cerebral, donde se coordinan respuestas integradas que afectan a la función del sistema respiratorio.
REFLEJO QUÍMICO
Los parámetros químicos utilizados para controlar tanto el ritmo como la profundidad respiratoria son la PaO2, la PaCO2 y el pH.
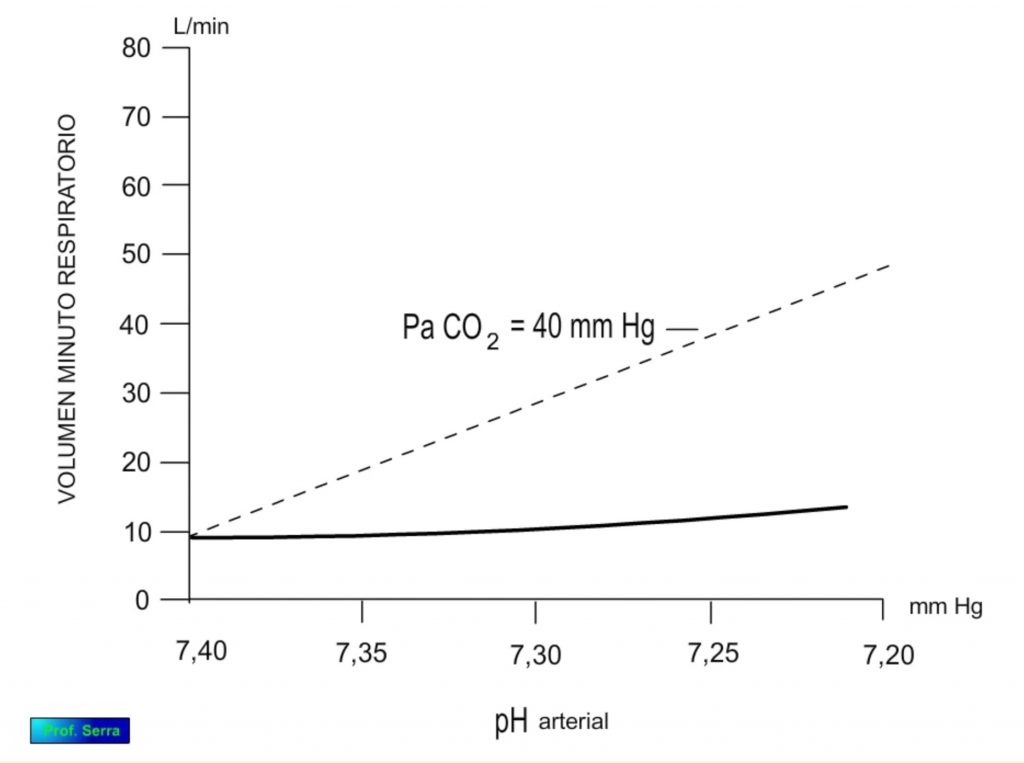
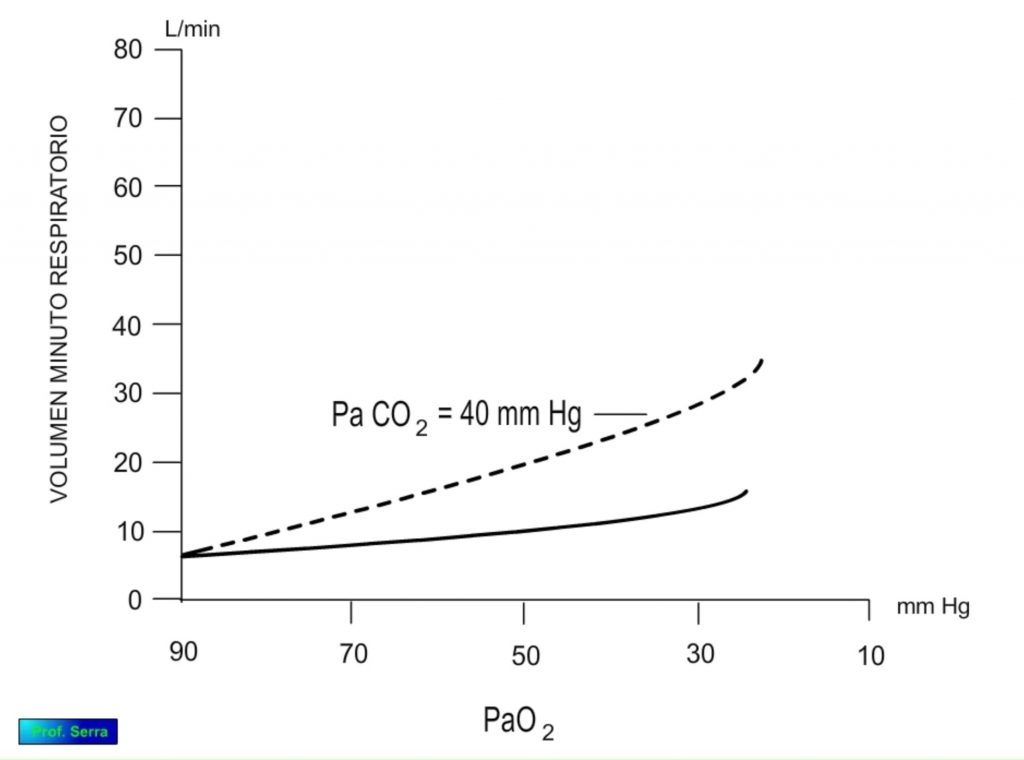
Si analizamos la respuesta ventilatoria frente al cambio individual de los parámetros químicos en sangre arterial, obtenemos las gráficas de las figuras 5 y 6.
Podemos ver como a medida que aumenta la PaCO2 aumenta linealmente la ventilación, hasta llegar a un valor de PaCO2 que por su toxicidad para el sistema (cerebro), el sistema de control falla en el control.
Si nos fijamos en las variaciones del pH arterial, observamos como a medida que aumenta la concentración de hidrogeniones aumenta la ventilación, aumentando mucho más si mantenemos constante la PACO2 . (Figura 5).
Por último, se observa como a medida que disminuye la PaO2 se produce un incremento lento de la ventilación, que no se hace importante hasta que los valores de la PaO2 caen por debajo de valores donde se compromete la oxigenación tisular (< 50 mm Hg). El efecto es mayor si mantenemos constante la PACO2 ya que de esta forma eliminamos el efecto regulador de este gas (Figura 6).
El principal parámetro químico con mayor efecto ventilatorio es el CO2 .
¿Dónde están situados los sensores químicos del sistema de control respiratorio?
Existen dos ubicaciones: Los periféricos situados junto a los receptores de presión del sistema sensor del aparato cardiovascular, y los centrales situados en el suelo del cuarto ventrículo cerebral. Cada uno de ellos especializados en testar predominantemente un parámetro químico.
SENSORES QUÍMICOS PERIFÉRICOS
Cuerpos carotídeos y cuerpos aórticos.
Los cuerpos carotídeos se encuentran situados en la bifurcación de las carótidas, con inervación sensorial del glosofaríngeo (IX) y un flujo sanguíneo de 2000 ml/100 g tejido/min. (33 veces más que el cerebro).
Miden el O2 disuelto. (Figura 5)
Histológicamente son células sensoriales tipo I o células glómicas rodeadas por células gliales (tipo II).
El neurotransmisor es la dopamina.
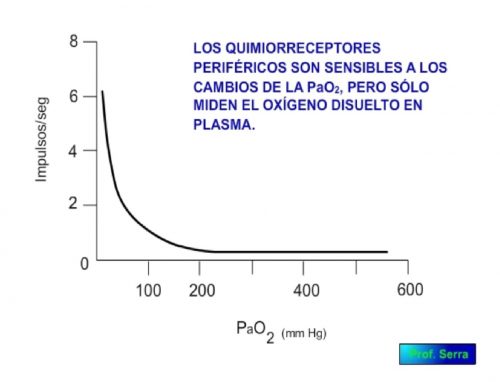
Figura-7: Cambios de ventilación frente al oxígeno disuelto.
El principal estímulo es la PaO2 seguido de la PaCO2 y el pH (Figura 6), aunque estos últimos requieren cambios importantes para ejercer un efecto.
Como se puede apreciar en la figura 7, estos sensores trabajan en el rango fisiológico de PaO2 de forma que por encima de una PaO2 de 200 ya no disparan. Y por debajo de una PaO2 de 40, la frecuencia de disparo es máxima.
SENSORES QUÍMICOS CENTRALES
En la base del cuarto ventrículo cerebral (en el bulbo) se encuentran neuronas sensibles a los cambios del CO2 en el líquido cefalorraquídeo (LCR) (Figura 8). Estas neuronas están en estrecha relación con los "centros respiratorios". Realmente son sensibles a los cambios en la concentración de hidrogeniones provocados por los cambios en la presión de CO2, el cual pasa fácilmente la barrera hematoencefálica.

Figura-17: Cambios de la ventilación por cambios en el CO2 cefalorraquídeo.
El CO2 una vez en el LCR se hidrata y forma CO3H– y H+ este incremento en hidrogeniones es el causante del incremento en la actividad de las neuronas inspiratorias. La respuesta es muy rápida, menor de 1 minuto, pero tiene un límite, de forma que a valores de PCO2 mayores de 70 mm Hg se produce un efecto paralizante de los centros respiratorios.
Si se hiperventila durante un tiempo, se puede mantener más tiempo suspendida la respiración.
INTERACCIONES ENTRE ELLOS
Cuando se utilizan drogas que disminuyen la sensibilidad del sensor central al CO2 (barbitúricos, morfina, etc.) se pone de manifiesto la regulación mediada por los quimioceptores periféricos. (Figura 9)
Si analizamos el efecto conjunto del O2 y CO2 en la regulación química del aparato respiratorio obtenemos los gráficos de la figura, donde podemos observar lo siguiente:
A medida que aumenta el valor de la PaCO2 se produce un incremento de la ventilación, que se hace máximo cuando los valores de la PaO2 caen por debajo de los valores vitales.

Figura-9: Interacción entre los sensores químicos.
Cuando analizamos los cambios de ventilación con respecto a la PaO2 observamos que son poco importantes y muy dependientes de los valores de la PaCO2, de forma que si estos últimos son mayores de 40 mm Hg se produce un aumento de la ventilación a medida que baja la PaO2, pero si están por debajo de 40, se necesita una caída importante de la PaO2 para que se produzca un aumento importante de la ventilación [1]El hecho de que entre los valores de 60 a 100 mm Hg en la PA O2 no se produzca un cambio importante en la ventilación se puede explicar por la acción cooperativa de dos efectos: la disminución de la PCO2 como consecuencia del ligero aumento de la ventilación, lo que supone inhibición de la misma; y el aumento de la desoxiHb que por ser un ácido débil hace subir el pH sanguíneo y consiguiente depresión de la ventilación.El hecho … Continúe leyendo.
La detención voluntaria de la respiración lleva a un incremento de la PaCO2 y caída de la PaO2 hasta un punto donde se produce un estímulo de los centros respiratorios por encima del control voluntario: Punto de ruptura. Este punto se puede atrasar si se seccionan los cuerpos carotídeos. También se puede alargar con hiperventilaciones previas, que bajen el valor de la PaCO2.
Consecuencia de este análisis es que el parámetro químico que gobierna la ventilación es la PaCO2 y que sólo se hace visible el papel de la PaO2 cuando éste alcanza valores que ponen en peligro la supervivencia celular.
En los trastornos del equilibrio ácido-base se observan cambios respiratorios.
En la acidosis metabólica (provocada por acumulación de ácidos no volátiles, por ejemplo cuerpos cetónicos (diabetes sacarina)) se produce un incremento de la ventilación (respuesta de Kussmaul).
En la alcalosis metabólica (por ejemplo, vómitos prolongados con pérdida de ClH) se produce disminución de la ventilación.
Por otra parte las modificaciones ventilatorias independientes a los cambios del equilibrio ácido-base ejercen cambios en éste:
La hiperventilación produce alcalosis respiratoria.
La hipoventilación produce acidosis respiratoria.
REFLEJOS MODULADORES DE LA RESPIRACIÓN DE ORIGEN NO QUÍMICO
Desde hace tiempo se sabe que la sección al nivel del cuello de los dos nervios vagos (neumogástricos), produce modificaciones respiratorias importantes en el animal anestesiado, disminuyendo su frecuencia respiratoria y aumentando considerablemente el volumen corriente. Estos efectos muestran que algunos mensajes sensoriales procedentes del sistema pulmonar que viajan por la sección sensorial del vago ejercen un importante efecto de control respiratorio. Además de éstos, existen otros reflejos de origen extrapulmonar que también ejercen un efecto modulador de la respiración.
RECEPTORES DE ADAPTACIÓN LENTA (RECEPTORES PULMONARES)
LOS RECEPTORES PULMONARES DE ADAPTACIÓN LENTA MODIFICAN EL PATRÓN BÁSICO RESPIRATORIO. (Animación 2)
Reflejo de Hering-Breuer o reflejo de la insuflación: Mecanoceptores de adaptación lenta situados en las paredes musculares de las vías de conducción. Son fibras mielínicas vagales tipo A (5 a 10 mm diámetro y velocidad de conducción de 35 a 50 metros/s) que responden al grado de estiramiento. Son receptores que se adaptan lentamente y son sensibles a pequeñas variaciones de la distensión, de forma que cuando aumenta ésta, aumenta el reclutamiento de estos receptores. Su información es de tipo inhibidor y su descarga aumenta al final de la inspiración, inhibiendo a las neuronas inspiratorias y activando a las neuronas espiratorias.
Animación 2: Receptores pulmonares de adaptación lenta.
Son detectores de volumen pulmonar (insuflación).
En el hombre se activa con volúmenes corrientes mayores de 1000 ml y cuando disminuye la distensibilidad pulmonar. Se piensa que está implicado en la inhibición de inspiración mantenida por lo que sirve para conservar el ritmo respiratorio, además de optimizar el trabajo respiratorio. La anestesia del vago hace desaparecer los cambios de ritmo y profundidad.
FUNCIONES:
- TERMINAR LA INSPIRACIÓN
- REGULAR EL TRABAJO RESPIRATORIO
- REFORZAR EL RITMO RESPIRATORIO EN EL PRIMER AÑO DE VIDA.
Efectos colaterales de este reflejo son: relajación del músculo liso de las vías aéreas, reducción del tono vasomotor periférico e incremento de la frecuencia cardiaca (taquicardia). Si el volumen pulmonar es muy alto producen bradicardia y vasodilatación periférica.
RECEPTORES DE ADAPTACIÓN RÁPIDA
LOS RECEPTORES PULMONARES DE ADAPTACIÓN RÁPIDA PARECEN IMPLICADOS EN LA DETECCIÓN DEL INICIO DE SUCESOS PATOLÓGICOS. RESPONDEN A LA IRRITACIÓN. (Figura 10)
Se encuentran por debajo de la superficie de las grandes vías de conducción entre las células epiteliales. El reflejo aparece por la acción de agentes irritantes y por cambios en ambos sentidos del volumen pulmonar. Son aferentes vagales mielinizadas y ramificadas por el epitelio pulmonar.
Su actividad es inversa a la compliancia pulmonar por lo que se les considera receptores de compliancia. También responden a partículas inhaladas, gases tóxicos, aumento del flujo aéreo, congestión pulmonar y deformación mecánica, mediadores químicos de las reacciones alérgicas. Su estimulación en la tráquea genera tos y en las áreas inferiores producen broncoconstricción, constricción laríngea y ventilación rápida y superficial
Su función fisiológica puede ser detectar el inicio de procesos patológicos pulmonares y nociceptivos. Producen tos, respiración dificultosa y aumentan el tiempo de inspiración.
NOCICEPTORES PULMONARES
LAS FIBRAS C PULMONARES Y BRONQUIALES TIENEN UNA FUNCIÓN NOCICEPTIVA. (Figura 10)
Son fibras C amielínicas que se distribuyen en los alvéolos: fibras C pulmonares y en los bronquios: fibras C bronquiales, que se estimulan por lesiones pulmonares, llenado excesivo o desinflado forzado, congestión vascular pulmonar aguda, agentes químicos, etc.
Los primeros también se denominan receptores capilares yuxtapulmonares y receptores J, sensibles principalmente a estímulos dolorosos de tipo mecánico. Los bronquiales son más sensibles a estímulos dolorosos de tipo químico.
Se estimulan por el incremento de líquido intersticial pulmonar y por la ingurgitación de los capilares pulmonares, así como por la desinflación, aunque de forma débil e inconstante. Su efecto respiratorio consiste en una respiración superficial y rápida, broncoconstricción, incremento de la secreción y disminución cardiovascular. Participan en la disnea por insuficiencia cardíaca.
Cuando la estimulación es intensa pueden producir apnea y disminución de la resistencia vascular periférica total.
REFLEJOS EXTRAPULMONARES
Reflejo de los músculos respiratorios:
Los músculos respiratorios son de tipo esquelético y consecuentemente poseen el sistema típico muscular de husos y órganos tendinosos de Golgi, con los cuales se regula, al nivel medular, la tensión de contracción muscular en función del estiramiento del mismo.
Reflejos articulares en la pared torácica: miden la velocidad del movimiento costal.
Los centros respiratorios determinan la fuerza muscular necesaria en cada respiración, pero los husos musculares respiratorios ajustan la contracción a las posibles resistencias que se encuentren dichos músculos. En definitiva, estabilizan la contracción muscular frente a estados mecánicos cambiantes.
Reflejos de los senos carotídeos y aórticos: Los cambios en la presión sanguínea además de afectar a la función cardiovascular, también afectan a la pulmonar de forma que aumentos en la Pa determinan disminución de la ventilación. Aunque se discute su papel funcional en el hombre, algunos defienden que en sujetos con presión arterial baja, el aumento de la ventilación determina disminución de la presión intratorácica que facilita el retorno venoso.
Reflejos somáticos y viscerales: La estimulación adecuada de los nervios procedentes de las extremidades puede generar incremento de la frecuencia respiratoria y de la profundidad respiratoria. Y se consigue por estimulación de receptores a la temperatura, dolor y mecanoceptores.
El enfriamiento superficial, así como la fiebre determina hiperventilación, así como el movimiento articular, mientras que el dolor visceral disminuye la frecuencia respiratoria.
La presión ocular determina inhibición cardíaca y disminución en la frecuencia respiratoria.
El estiramiento del esfínter anal en el recién nacido puede iniciar o aumentar la respiración (una forma de corregir la depresión respiratoria en el recién nacido es "nalguear" vigorosamente al recién nacido, regar su piel con agua fría o distender el esfínter anal).
La deglución, náuseas y el vómito determinan reflejos respiratorios encaminados a evitar la obstrucción de las vías respiratorias, produciendo un paro respiratorio, cierre de la glotis y en caso del vómito, contracción de los músculos abdominales que llevan a un importante incremento de la presión intraabdominal que favorece la expulsión del contenido gástrico.
ALTERACIONES RESPIRATORIAS
Durante el sueño, se produce:
-Una disminución de la sensibilidad en los centros respiratorios en un 50%.
-Se produce un aumento de la resistencia de las vías aéreas superiores. Aparte de los obstáculos anatómicos en las vías, el tono de los músculos que dilatan las vías respiratoria disminuye.
-Alteraciones de dinámica respiratoria: En la fase Rem se producen alteraciones del ritmo y la intensidad respiratoria, pues se reduce el tono de los intercostales, aunque el diafragma sigue funcionando normalmente.
Las personas que sufren de la maldición de Ondina clásicamente sufren de paro cardiorrespiratorio durante el sueño. El síndrome de Ondine consiste en un síndrome de hipoventilación central congénita secundario, un trastorno del sistema nervioso central (SNC) en el cual el control autonómico de la respiración está ausente o se encuentra deteriorado en ausencia de cualquier enfermedad que lo justifique.
FISIOLOGIA. / RESPIRATORIO / REGULACIÓN DEL SISTEMA RESPIRATORIO
ENLACES DEL TEMA EN LA WEB
Regulación de la respiración: Organización morfo funcional de su sistema de control.
Regulación de la respiración.
Cambios fisiológicos en el sueño.
Control de la respiración
VIDEOS EN YOUTUBE
PATOLOGÍA
Trastornos respiratorios durante el sueño.
Apnea del sueño: causas, síntomas y tratamiento.
Respiración de Cheynet-Stokes
Respiración de Kussmaul
Síndrome de Ondina
![]()








 Views Today : 207
Views Today : 207 Views This Month : 1838
Views This Month : 1838 Views This Year : 27461
Views This Year : 27461 Total views : 313524
Total views : 313524