Ingrese su ID de correo electrónico
FISIOLOGIA. / CARDIOVASCULAR. / CORAZÓN. /MORFOFUNCIÓN CARDÍACA.
ASPECTOS MORFO FUNCIONALES DEL CORAZÓN Y SUS CÉLULAS
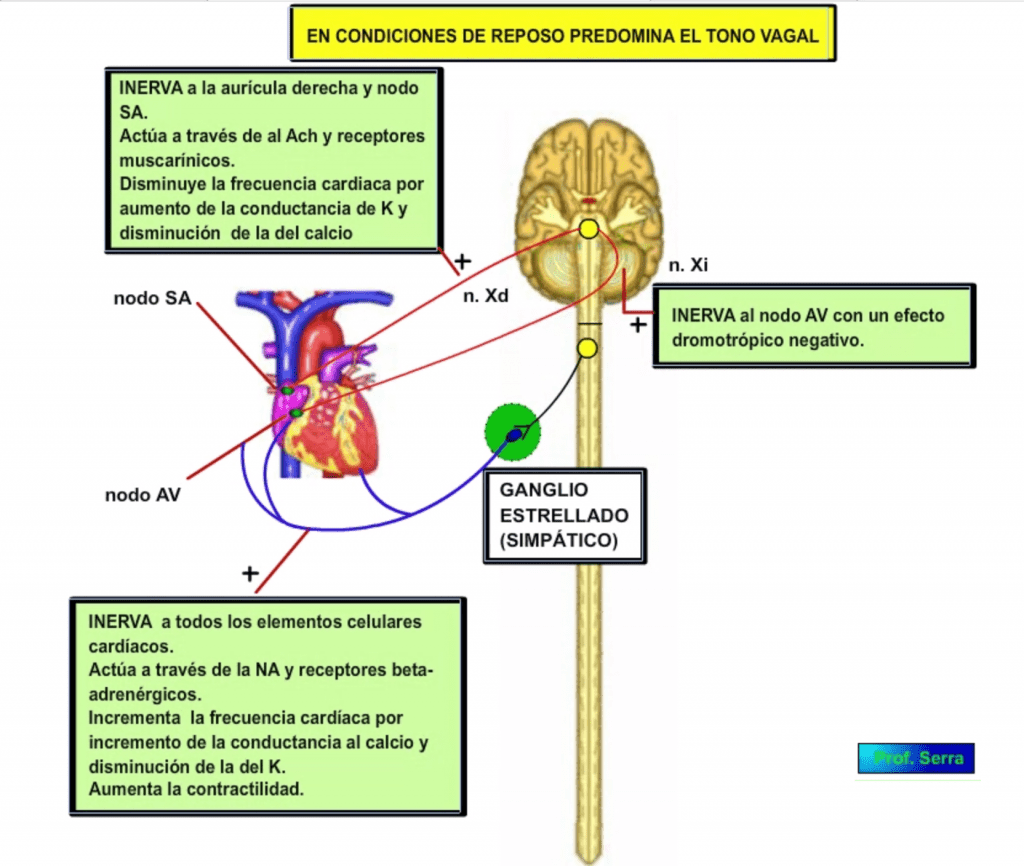
INERVACIÓN CARDÍACA
El corazón está inervado por dos ramas nerviosas de orígenes diferentes (figura 1). La rama simpática cuyas fibras postganglionares nacen en el ganglio estrellado y acaban sobre todos los tipos celulares del corazón. Su transmisor es la noradrenalina (NA) y los receptores cardíacos son del tipo beta-adrenérgicos. La estimulación simpática supone un incremento de las conductancias para el calcio y el sodio, por lo que se produce un incremento tanto de la frecuencia cardíaca, como de la conductibilidad, como de la contractilidad.
La rama parasimpática procede del par craneal X (vago) y cada rama inerva diferencialmente a cada nodo auricular derecho. La rama derecha inerva a las células del nodo sinusal donde disminuye la frecuencia marcapasos por su efecto inhibidor de las corrientes de calcio y sodio y estimulador de las corrientes de potasio. La rama izquierda disminuye la conductibilidad en el nodo auriculo ventricular. El neurotransmisor utilizado es la acetilcolina (Ach) y los receptores cardíacos son de tipo muscarínico.
En condiciones de reposo predomina el tono vagal.
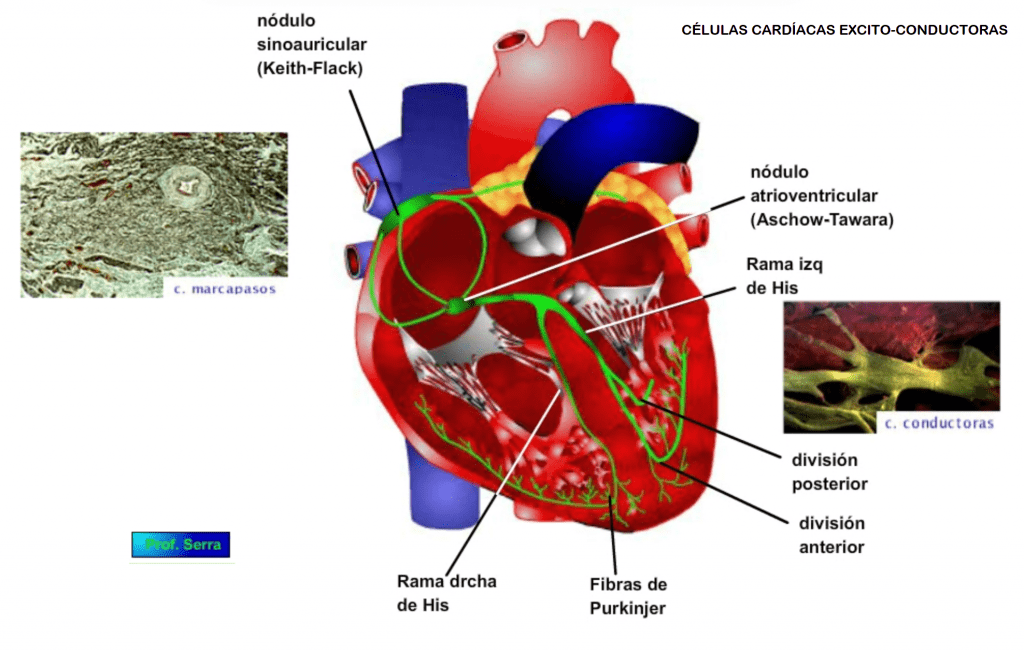
CÉLULAS CARDÍACAS EXCITO-CONDUCTORAS
Las células excitoconductoras (CEC) tienen forma redondeada o alargada. Poseen pocas proteínas contráctiles dispersas por su protoplasma y carecen de sistema sarcotubular. (Figura 2)
Han perdido la capacidad para contraerse y se han especializado en crear PA (potenciales de acción) de forma automática (células excitadoras o marcapasos) y conducirlos (células conductoras) desde un punto a otro del corazón. Las CEC se agrupan formando nódulos y haces.
En los nódulos sinoauricular o de Keith-Flack y atrioventricular o de Aschow-Tawara predominan las células excitadoras y las conductoras en el haz de His y sus ramas y en las fibras de Purkinje.
CÉLULAS CARDÍACAS CONTRÁCTILES
Las células musculares del corazón o tejido miocárdico, presentan características estructurales de tejido muscular esquelético, ya que poseen estrías transversales como éstos, formadas por filamentos contráctiles ordenados en sarcómeras o unidades contráctiles. Sin embargo, desde un punto de vista funcional presentan características de músculo liso, ya que muestran un comportamiento sincitial, al contraerse todo el tejido, de forma todo o nada cuando es activado por un estímulo supraumbral, procedente de las células marcapasos y modulado por la inervación externa.(Figura 3)
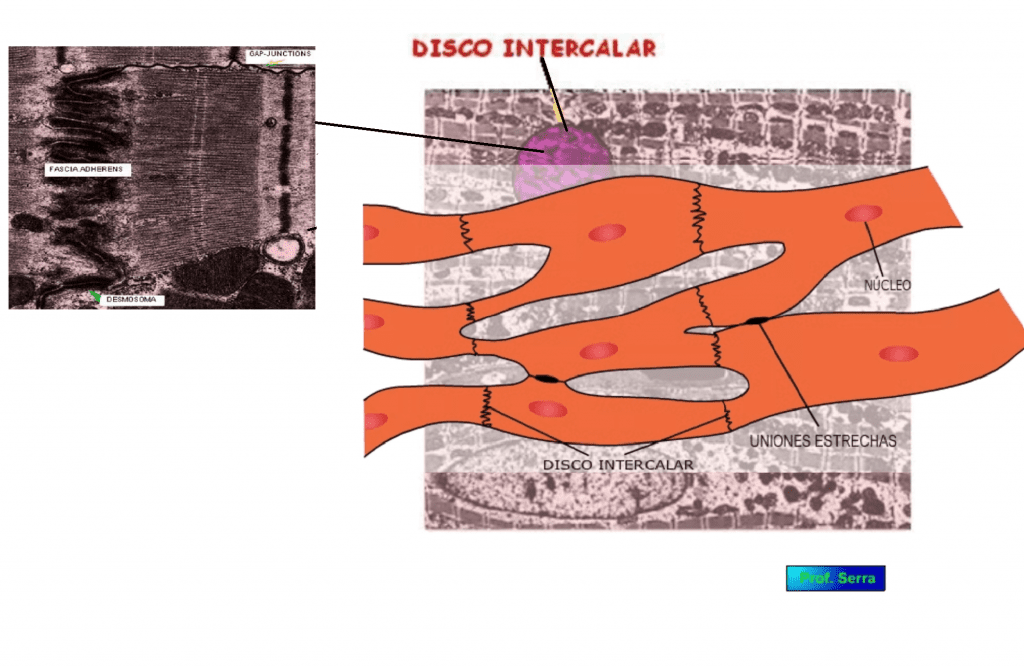
Las células miocárdicas de aproximadamente 50 a 100 um de longitud y 14 a 20 um de diámetro se disponen de forma más o menos paralela, conectándose entre sí por los extremos y laterales, lo que permite zonas de baja resistencia eléctrica (gap-junctions), causantes de la rápida propagación de la despolarización causada por el estímulo bioeléctrico. En los extremos celulares las membranas citoplasmáticas de las dos células en continuidad, forman una serie de pliegues paralelos, que dan gran cohesión a dicha continuidad. Estos pliegues se denominan discos intercalares, y facilitan la propagación de la fuerza de contracción. Estas dos estructuras son la causa del comportamiento sincitial de este tejido muscular. [1]Las células cardíacas se unen entre sí conservando sus límites morfológicos pero comportándose funcionalmente como una sola célula (sincitio funcional) gracias a la existencia de los discos intercalares. En éstos se produce el anclaje mecánico y el acoplamiento eléctrico entre las células cardíacas. Esto explica que el corazón cumpla la ley del todo o nada, es decir o se contrae o no se contrae como si fuese una sola … Continúe leyendo
Los discos intercalares son formaciones especializadas que sirven para unir las células contráctiles próximas. Por su forma ramificada, una célula puede unirse con otras. En los discos intercalares, los desmosomas (ver detalle) son las zonas en donde se fijan las fibras de actina de la última sarcómera al sarcolema y los sarcolemas de las células contiguas, anclando mecánicamente ambas células contráctiles e impidiendo que al contraerse se separen. Esta organización determina que la contracción simultánea de muchas células contráctiles se comporten como si de una sola célula mucho más larga se tratara, disminuyendo considerablemente la distancia entre sus extremos. Este acortamiento acumulado permite reducir el volumen de las aurículas y ventrículos durante la contracción. En los discos intercalares existen también gap-junctions (canales proteícos que permiten el paso de iones y corrientes iónicas entre células contiguas, canales intercelulares), acoplando eléctricamente a las células contráctiles. Un Va (potencial de acción) que se conduce por el sarcolema de una célula contráctil despolariza a la célula contráctil próxima por el movimiento iónico que se produce por el canal intercelular. Esta segunda célula, cuando alcance el potencial umbral, descargará un potencial de acción que conducirá a lo largo de su propia membrana hasta llegar a la célula próxima. Todas las células contráctiles están pues acopladas eléctricamente, la activación de una de ellas activará a todas las demás.
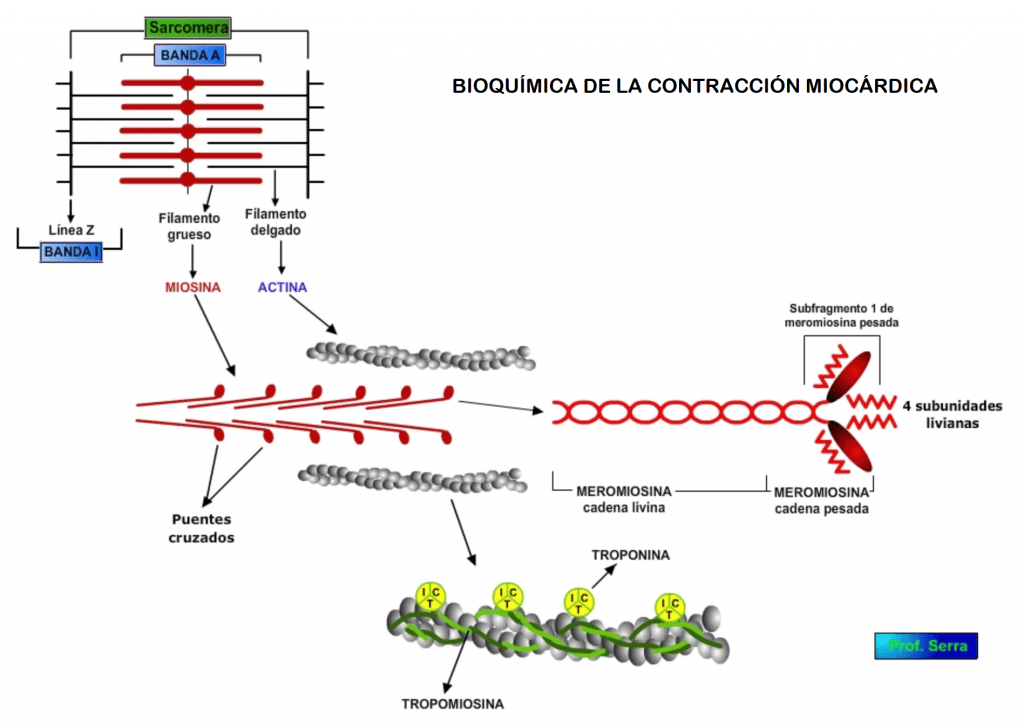
(Figura 4) Cada célula miocárdica contiene en su interior miofibrillas (responsables de la función contráctil) y mitocondrias (responsables de la producción de energía) (cuyo conjunto supone el 85% del contenido intracelular). Las miofibrillas son estriadas, al presentar bandas claras o bandas I (por su isotropía) y bandas oscuras o bandas A (por su anisotropía). Cada banda I está dividida en su mitad por un línea Z, y la región entre dos líneas Z se denomina sarcómera (unidad contráctil del músculo). El acortamiento de la sarcómera por deslizamiento activo entre los filamentos de actina y miosina, determina la contracción de la fibra muscular.
Cada célula miocárdica está rodeada por una membrana exterior formada por la propia membrana citoplasmática en aposición con la membrana basal, conjunto denominado sarcolema. Este sarcolema se invagina perpendicularmente, atravesando la célula a la altura de las líneas Z de la sarcómera, formando una red de túbulos transversos denominados túbulos T. El diámetro de estos túbulos es de aproximadamente 100 a 1000 Å y su luz es continua con el espacio extracelular. Junto a este sistema tubular, se encuentra el retículo sarcoplásmico, sistema intracelular de túbulos, profusamente conectados y dispuestos paralelamente a las sarcómeras, con la particularidad de que a la altura de las líneas Z, forman unas cisternas en estrecho contacto con los túbulos transversos, creándose zonas de baja resistencia eléctrica. Este conjunto formado por las cisternas y un túbulo, en medio de las líneas Z se denomina Díada (en vez de en las uniones A-I del músculo esquelético). El túbulo está encargado de la rápida propagación del potencial de acción generado en la membrana citoplasmática de la fibra, mientras que el retículo sarcoplásmico está relacionado con los movimientos de calcio y el metabolismo muscular.
POTENCIAL DE ACCIÓN EN CÉLULAS CONDUCTORAS Y CONTRÁCTILES
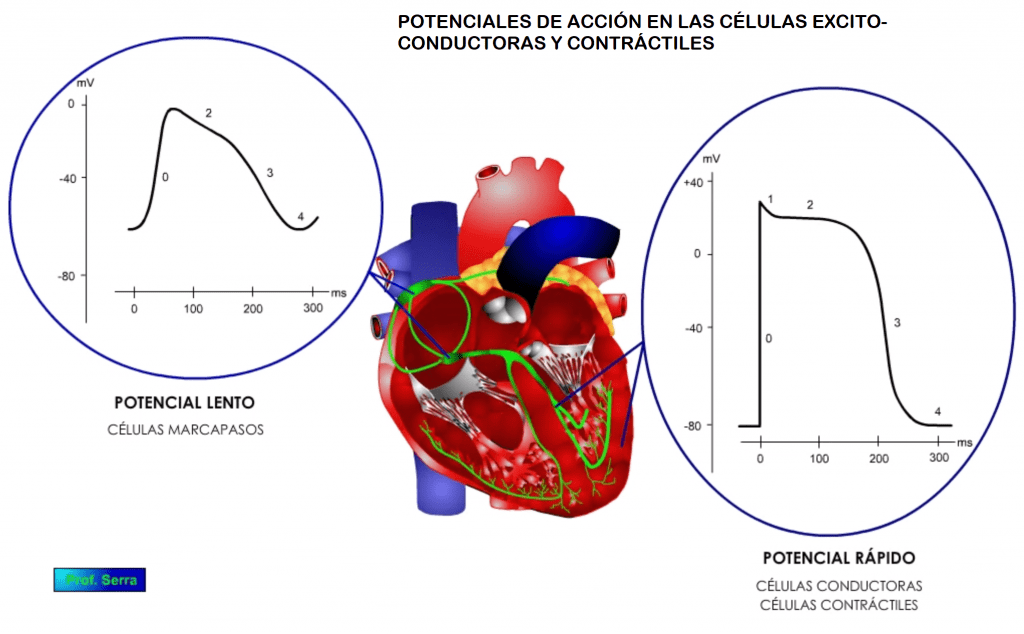
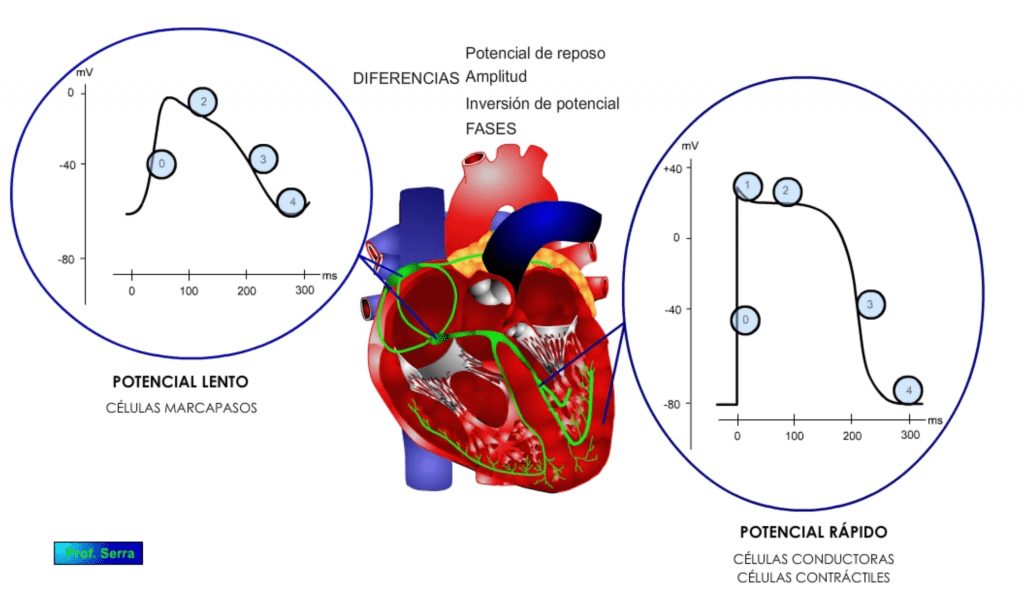
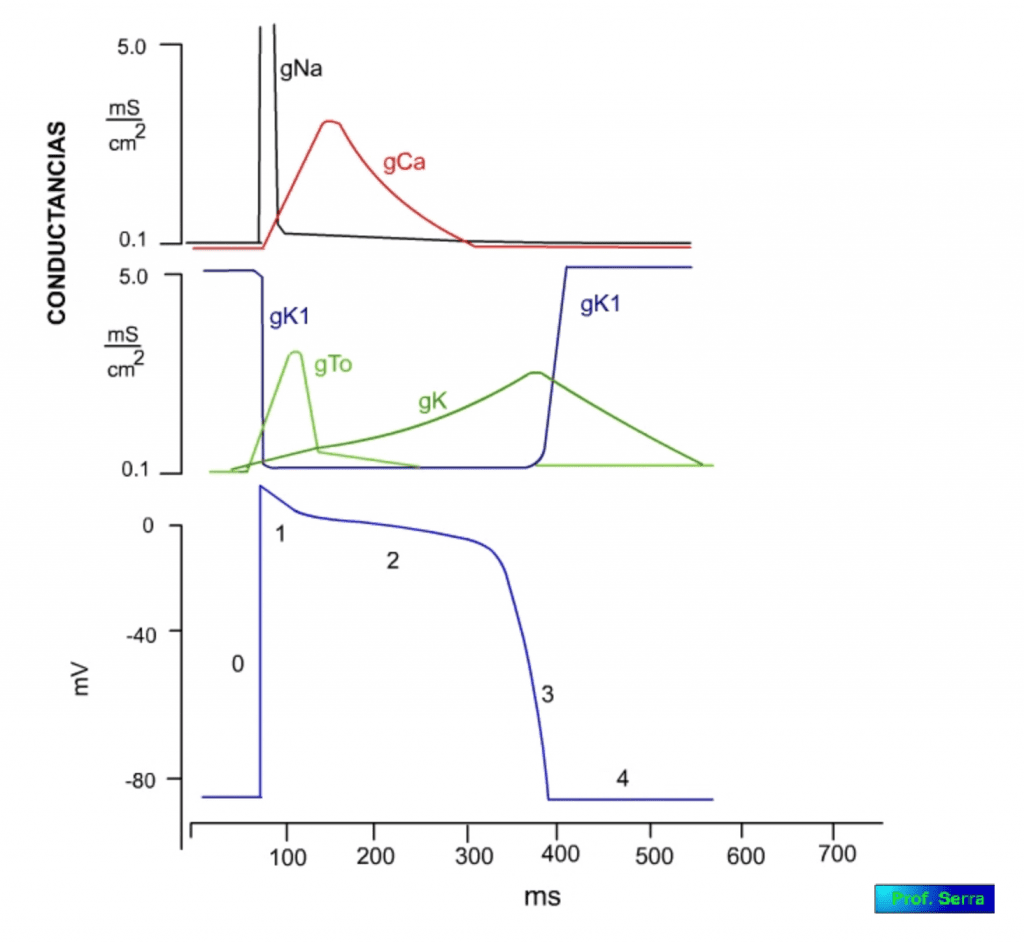
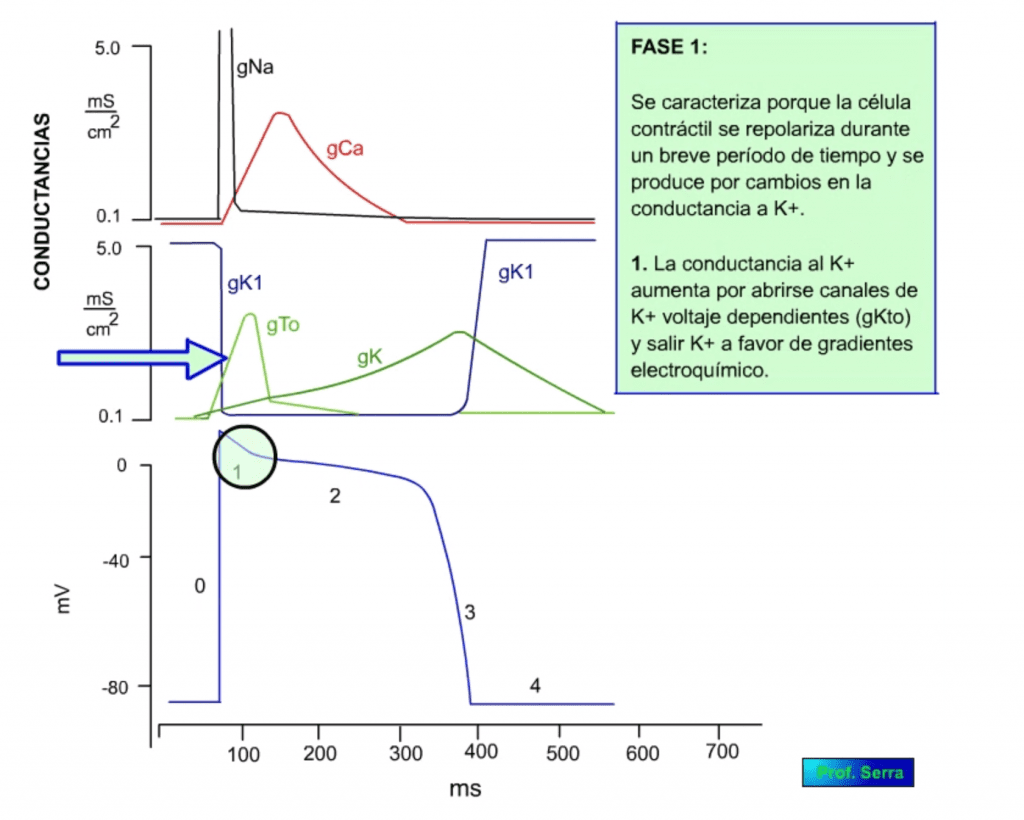
Tanto las células contráctiles como las conductoras (figura 6), cuando son excitadas con estímulos supraumbrales, sus membranas se despolarizan y generan un potencial de acción, llegando a invertirse su potencial hasta alcanzar unos +20 mV. El potencial de acción, denominado potencial de acción rápido, muestra cinco fases características. Una fase 0 o de despolarización rápida, donde se invierte el potencial, seguida de una fase rápida (fase 1) de repolarización parcial.
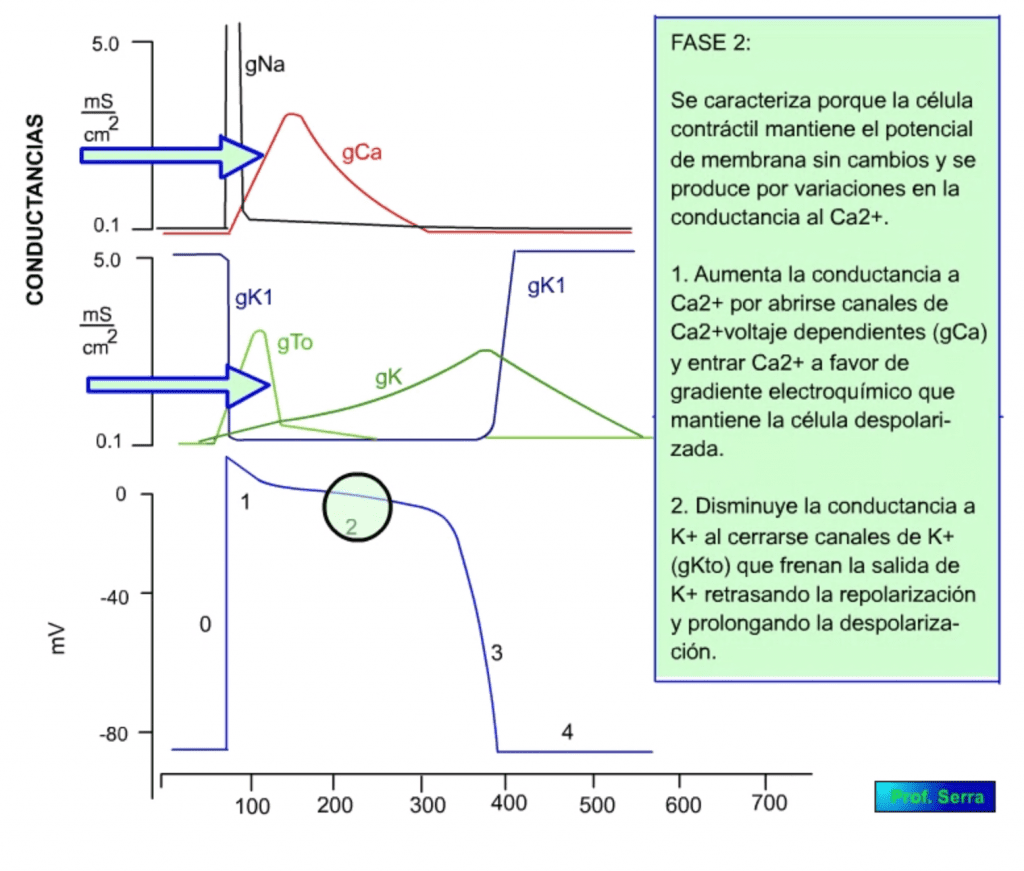
A continuación le sigue una fase meseta o fase 2 de unos 0,2 s, para dejar paso a una fase de repolarización o fase 3 que lleva el potencial a su valor de reposo o fase 4.
La apertura y cierre secuencial en el tiempo, de los diferentes canales iónicos voltaje-dependientes, determinan las diferentes corrientes iónicas de sodio, potasio y calcio, que determinan la morfología del registro del potencial de acción.
En las células automáticas o marcapasos, la morfología del potencial de acción, denominado potencial de acción lento, generado como respuesta a una estimulación supraumbral es diferente, mostrando una fase menos, es decir cuatro fases: 0, 2, 3 y 4. (Figura 10)
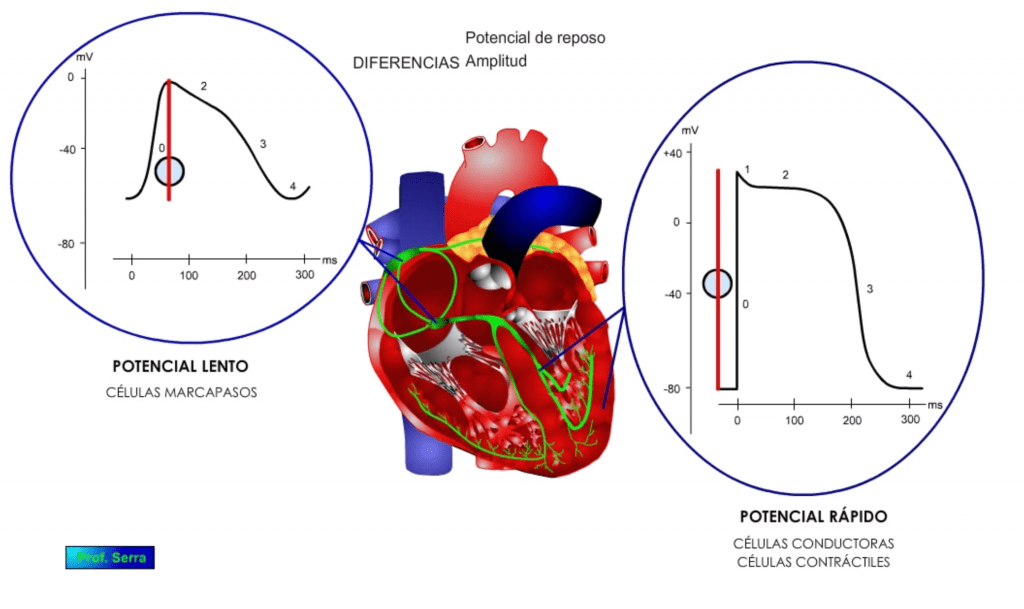
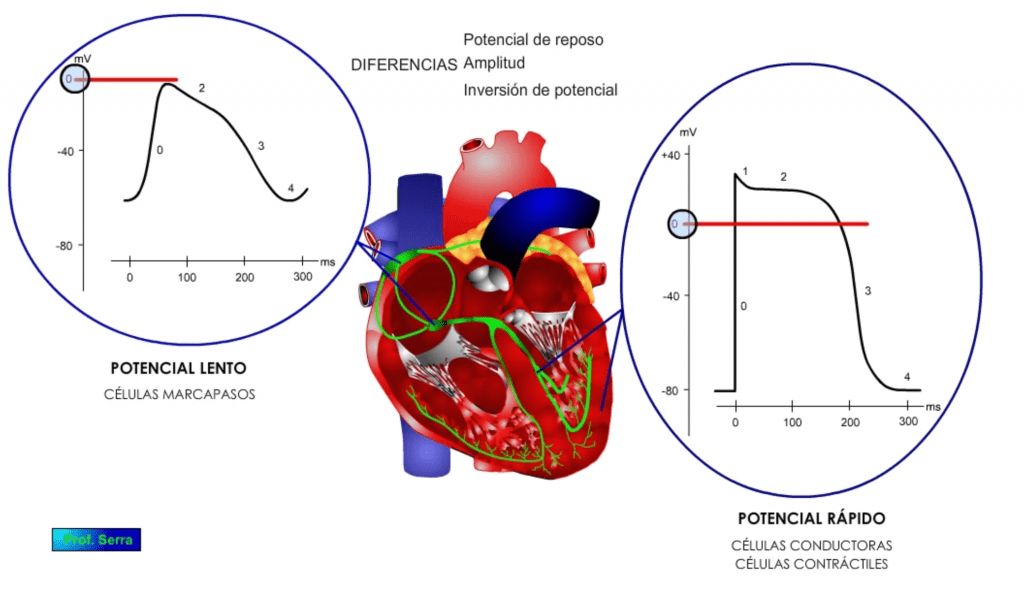
Además de estas diferencias en las fases, se pueden observar otras diferencias importantes como son: las diferencias en el valor del potencial de reposo (figura 7); en la amplitud del potencial alcanzado (figura 8) y en la inversión del mismo (figura 9). Todo ello se debe a las diferentes características y tipos de conductancias que poseen estas poblaciones celulares.
BASES IÓNICAS DEL POTENCIAL DE MEMBRANA EN LAS CÉLULAS MARCAPASOS (ver animación)
La relación entre las conductancias de Na+ y de K+ explican el bajo valor de la máxima despolarización diastólica. Una alta conductancia al Na+ y una baja conductancia al K+ determinan que el Vm se sitúe más próximo al potencial de equilibrio al Na+ que en el caso de las células no automáticas.
La elevada permeabilidad al Na+ se debe a la existencia de canales catiónicos no selectivos por donde pasa el Na+ que poseen las células automáticas, y que permiten en reposo la existencia de una corriente de entrada de sodio (If). La baja permeabilidad a K+ se debe a la falta de canales de K+, IK1, que alejan el Vm del potencial de equilibrio al K+.
Cambios progresivos en la conductancia a Ca2+, Na+, y la falta de conductancias al K+ producen la inestabilidad del Vm en reposo. Las células automáticas durante la fase de reposo expresan unas corrientes crecientes de entrada de Na+ (I Na+) a través de canales catiónicos no selectivos (If) y de Ca2+ ( I Ca2+) a través de canales de Ca2+ voltaje-dependientes. Esta despolarización progresiva que hace inestable el Vm no está frenada por una posible salida de K+, pues el único canal de K+ que poseen estas células, el IK, está en este período cerrado. Este proceso de despolarización continua hasta que se alcanza el umbral para desencadenar el Va.
Solo conductancias de Ca2+ participan en la fase de despolarización del Va de las células automáticas. Las células automáticas no tienen corrientes de Na+ (I Na+)durante la fase de despolarización porque carecen de canales de Na+ voltaje-dependientes. Esta fase es lenta porque estos canales tienen una cinética de apertura lenta. La despolarización generada por la entrada de calcio, activa los canales de potasio Ik responsables de que la membrana se repolarice lentamente.
BASES IÓNICAS DE LOS POTENCIALES RÁPIDOS
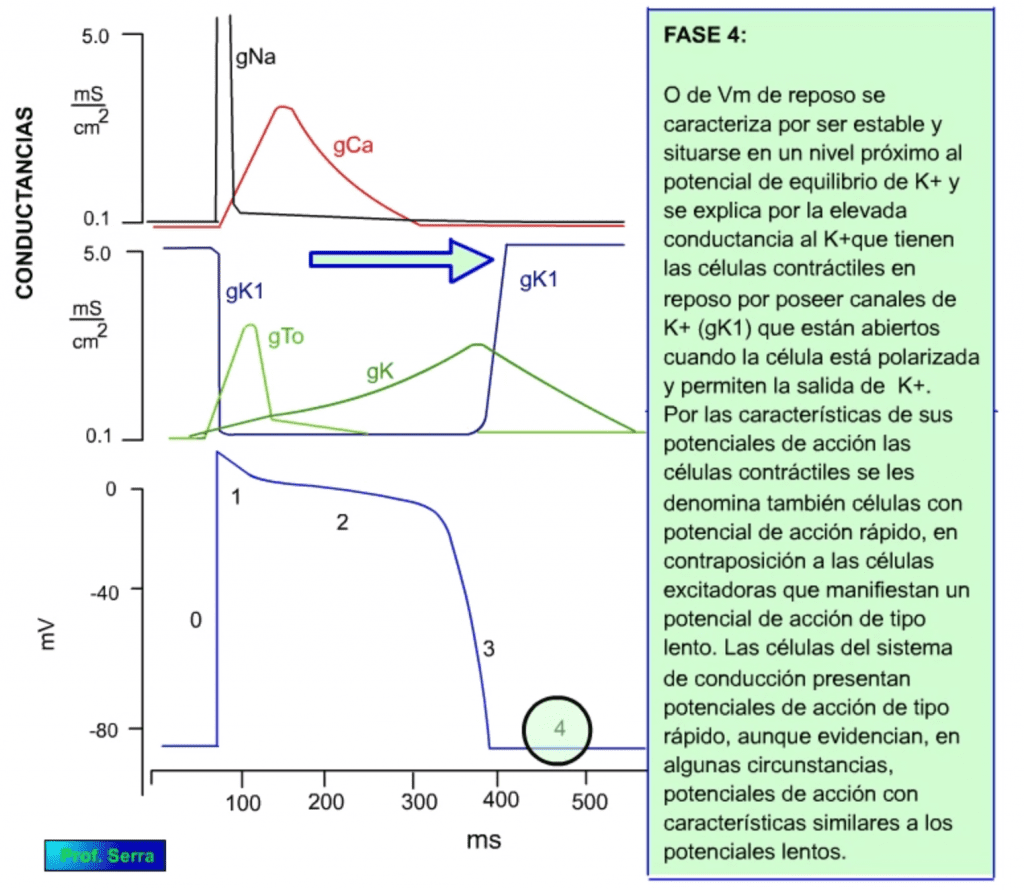
Potencial de membrana en reposo estable con un valor próximo al potencial de equilibrio del K+ (unos -90 mV). (Figura 12)
Potencial de acción de unos 300 ms de duración en el que se reconocen cuatro fases que se muestran en las figuras de más abajo.
A valores del potencial umbral se abren las compuertas de activación en las conductancias de Na que permiten el paso rápido de sodio que despolariza la célula, lo cual es un estímulo para que se abran más compuertas de activación, por lo que el proceso se convierte en regenerativo (figura 13).
Este proceso determina una gran entrada de sodio con lo que el potencial de membrana se acerca al potencial de equilibrio para dicho ión (+42 mV). Cuando se alcanzan valores muy bajos de potencial, potenciales de inversión o cercanos, se activan las compuertas de inactivación, por lo que cesa la entrada de sodio, este hecho es el que determina que el potencial de membrana no iguale al potencial de equilibrio para el sodio, dado que la inactivación se produce antes de alcanzarlo. Este proceso de inactivación es más lento que el de activación. La despolarización alcanzada activa a las corrientes ITo de potasio lo que supone una pequeña repolarización que supone la fase 1 (figura 14) y la inactivación de las corrientes de sodio. Así mismo se activan las corrientes ICa de calcio que determinan la fase 2 o de meseta (figura 15), con entrada de calcio necesario para la contracción muscular. La inactivación de estas corrientes de calcio coinciden con la activación de las corrientes IK de potasio y comienzo de la fase 3 (figura 16) de repolarización que al final activa a las corrientes IK1 de potasio responsables de la fase 4 (figura 17).
Cuando a estas células se las trata con tetrodotoxina (bloqueante de canales rápidos de Na+) se convierten en células con potenciales de acción lentos.
ENLACES DEL TEMA EN LA WEB
VIDEOS EN YOUTUBE
PATOLOGÍAS
FISIOLOGIA. / CARDIOVASCULAR. / CORAZÓN. /MORFOFUNCIÓN CARDÍACA.
![]()






 Views Today : 322
Views Today : 322 Views This Month : 574
Views This Month : 574 Views This Year : 14339
Views This Year : 14339 Total views : 300402
Total views : 300402